题目内容
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是
A.反应A的△H>-115.6kJ·mol-1
B.H2O中H—O键比HCl中H—Cl键弱
C.由II中的数据判断氯元素的非金属性比氧元素强
D.断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
【答案】D
【解析】
试题分析:A、反应A的△H=-115.6kJ/mol,故A错误;B、E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4molHCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,H2O中H—O键比HCl中H—Cl键强,故B错误;C、由反应Ⅱ判断,氧气能够将氯氧化为氯气,氯元素的非金属性比氧元素弱,故C错误;D、E(H-O)、E(HCl)分别表示H-O键能、H-Cl键能,反应A中,4molHCl被氧化,放出115.6kJ的热量,反应热△H=反应物总键能-生成物的总键能,故:4×E(H-Cl)+498kJ/mol-[2×243kJ/mol+4×E(H-O)]=-115.6kJ/mol,整理得,4E(H-Cl)-4E(H-O)=-127.6kJ/mol,即E(H-O)-E(HCl)=31.9kJ/mol,故断开1molH-O键与断开1molH-Cl键所需能量相差约为31.9kJ/mol×1mol=31.9kJ≈32kJ,故D正确;故选D。

【题目】工业上回收利用某合金废料(主要含Fe、Cu、Co、Li等,已知Co、Fe都是中等活泼金属)的工艺流程如下:

(1)金属M为 。
(2)加入H2O2的作用是(用离子方程式表示) ,加入氨水的作用是 。
(3)CoC2O4﹒2H2O高温焙烧的化学方程式为 。
(4)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系见下表。操作2中,蒸发浓缩后必须趁热过滤,其目的是 ,90℃时Ksp(Li2CO3)的值为 。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/molL-1 | 0.21 | 0.17 | 0.14 | 0.10 |
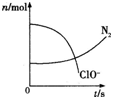
【题目】从能量的变化和反应的快慢等角度研究反应具有重要意义。
(1)已知反应2H2+O2 =2H2O为放热反应,下图能正确表示该反应中能量变化的是 。

化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
从断键和成键的角度分析上述反应中能量的变化。化学键的键能如右表:则生成1mol水可以放出热量____________kJ
(2)原电池可将化学能转化为电能。将质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,设计成原电池,负极材料是 , 正极的反应式为 ,电解质溶液中SO42- 移向 极(填“正”或“负”)。一段时间后,取出洗净、干燥、称量,二者质量差为12.9 g。则导线中通过的电子的物质的量是 mol。
(3)一定温度下,将3 molA气体和1mol B气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g) ![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为 ;X为 。若反应经2min达到平衡,平衡时C的浓度 0.8mol/L(填“大于,小于或等于”)。
【题目】(1)研究NO2、SO2、CO等大气污染气体的处理具有重要意义。 已知:
2SO2(g)+O2(g) 2SO3(g) ΔH= -196.6kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH= -113.0kJ·mol-1
2NO2(g) ΔH= -113.0kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol-1
SO3(g)+NO(g)的ΔH= kJ·mol-1
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是 (填序号)。
A.容器中混合气体的密度不随时间变化 |
B.断裂3 mol H-H键的同时形成6 mol N-H键 |
C.N2、H2、NH3的物质的量之比为1:3:2 |
D.容器中的压强不随时间变化 |
(3)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,则该反应的热化学方程式是____________。