题目内容
8.下列做法正确的是( )| A. | 用量筒量取20.21mL质量分数为98%的浓H2SO4 | |
| B. | 将5.85g NaCl溶入100mL水中,制得1 mol/LNaCl溶液 | |
| C. | 将22.4LHCl气体溶于水配成1 L且浓度为1 mol/L的盐酸 | |
| D. | 将1体积cmol/L的硫酸用水稀释为5体积,以获得浓度为0.2cmol/L的硫酸 |
分析 A.量筒的最小读数为0.1mL,无法读到0.01mL;
B.量氯化钠溶于100mL水中,所得溶液体积不是100mL;
C.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算;
D.根据稀释过程中溶质的物质的量不变进行计算.
解答 解:A.量筒只能读到0.1mL,量取20.21mL质量分数为98%的浓H2SO4应该使用酸式滴定管,故A错误;
B.5.85g氯化钠的物质的量为0.1mol,将0.1mol氯化钠溶于100mL水中,所得溶液体积不是100mL,溶于浓度不是1mol/L,故B错误;
C.不是标准状况下,不能使用标准状况下的气体摩尔体积计算22.4L氯化氢的物质的量,故C错误;
D.将1体积cmol/L的硫酸用水稀释为5体积,稀释过程中溶质的物质的量不变,则稀释后获得浓度为:$\frac{cmol/L×1}{5}$=0.2cmol/L,故D正确;
故选D.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量与物质的量浓度、气体摩尔体积的关系为解答关键,注意掌握标准状况下气体摩尔体积的使用条件,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
18.已知蓝色硫酸铜溶液会跟无色溴离子作用,生成绿色的四溴合铜离子:
CuSO4(aq蓝色)+4KBr(aq)?K2[CuBr4](aq绿色)+K2SO4(aq),当温度升高时,该溶液中四溴合铜离子的浓度增大,所以溶液呈绿色.下列说法正确的是( )
CuSO4(aq蓝色)+4KBr(aq)?K2[CuBr4](aq绿色)+K2SO4(aq),当温度升高时,该溶液中四溴合铜离子的浓度增大,所以溶液呈绿色.下列说法正确的是( )
| A. | 正反应放热 | B. | 加水平衡不移动 | ||
| C. | 加入K2SO4固体,平衡向左移动 | D. | 加入K2SO4溶液,平衡向左移动 |
19.Na2O和Na2O2在下列哪些点性质上是相同的( )
| A. | 颜色、状态、属于碱性氧化物 | |
| B. | 与盐酸反应所观察到现象 | |
| C. | 长期置放在空气中的最终产物 | |
| D. | 与水反应后滴加酚酞所观察到的现象 |
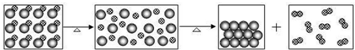
3.法国科学家拉瓦锡研究空气的组成时给固体氧化汞加强热,氧化汞受热时的变化可用如图表示(图中 表示汞原子,
表示汞原子, 表示氧原子),下列说法错误的是( )
表示氧原子),下列说法错误的是( )
 表示汞原子,
表示汞原子, 表示氧原子),下列说法错误的是( )
表示氧原子),下列说法错误的是( )
| A. | 氧化汞受热时能分解成汞和氧气 | |
| B. | 原子在化学变化中不能再分 | |
| C. | 氧化汞分子是由氧原子和汞原子构成的 | |
| D. | 所有物质都是由分子构成的 |
20.对于淀粉和纤维素这两种物质,下列说法正确的是( )
| A. | 它们均属于糖类,且互为同系物 | |
| B. | 二者含有C、H、O三种元素的质量分数相同,且互为同分异构体 | |
| C. | 二者都能水解,且水解的最终产物相同 | |
| D. | 都可用(C6H10O5)n表示,但淀粉能发生银镜反应,而纤维素不能 |
18.下列变化需要加人适当的氧化剂才能完成的是( )
| A. | S2-→HS- | B. | FeCl2→FeCl3 | C. | H2SO4→SO2 | D. | HNO3→N2O |

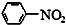 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$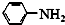 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$

 ;
; ;该反应的目的是保护在硝化过程中醇羟基不被氧化;
;该反应的目的是保护在硝化过程中醇羟基不被氧化; .
.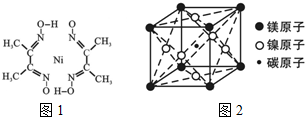 金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题.
金属镍及其化合物在合金材料以及催化剂等方面应用广泛.根据要求回答下列问题. )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.