题目内容
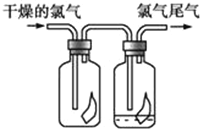
【题目】(1)如图所示,将氯气依次通过盛有干燥的有色布条和湿润的有色布条的广口瓶,可观察到的现象是__________________________________.
(2)写出C12与水反应的化学方程式________________________
(3)为防止氯气污染空气,可用氢氧化钠溶液吸收多余的氯气,原理是________________(用化学方程式表示).根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是________(填化学式,下同)。
(4)氯气泄漏时,人们需尽快远离现场,可用浸有一定浓度某物质水溶液的毛巾捂住口鼻,最适宜采用的物质是__________.
A.NaOH B.NaCl C.KBr D.Na2CO3.
【答案】 干燥的有色布条无明显现象,潮湿的有色布条褪色 Cl2+H2O=HCl+HClO Cl2+2NaOH=NaCl+NaClO+H2O Ca(ClO)2 D.
【解析】(1)氯气与水反应生成的次氯酸具有漂白性,所以干燥的氯气通过干燥的有色布条不会褪色,而通过潮湿的有色布条时,布条褪色;
(2) C12与水反应的化学方程式为Cl2+H2O=HCl+HClO
(3) C12能与NaOH溶液反应,所以可用氢氧化钠溶液吸收多余的氯气,反应原理为Cl2+ 2NaOH=NaCl+NaClO+H2O;C12与石灰乳反应制漂白粉的方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,起漂白作用时Ca(ClO)2与水和CO2反应生成的HClO,所以漂白粉的有效成分为Ca(ClO)2。
(4)A、氯气能被NaOH溶液吸收,但NaOH溶液具有很强的腐蚀性,不能与皮肤接触,所以A错误;B、NaCl不能吸收氯气,故B错误;C、KBr能与氯气反应,但生成的溴单质同样有毒,所以C错误;D、氯气能被Na2CO3溶液吸收,且Na2CO3溶液对皮肤没有伤害,所以D正确。正确答案为D。

 名校课堂系列答案
名校课堂系列答案