题目内容
下列有关说法正确的是( )
| A、25℃与60℃时,纯水的pH相等 | B、CaCO3难溶于稀硫酸,也难溶于醋酸 | C、电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | D、反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
分析:A.根据温度对水的电离平衡的影响解答;
B.碳酸钙和硫酸反应生成一种微溶物质硫酸钙,覆盖在碳酸钙表面隔绝了碳酸钙与硫酸的继续反应;碳酸钙和醋酸反应生成一种易溶于水的物质醋酸钙,碳酸钙消耗醋酸产生氢离子,促进醋酸电离平衡右移,使反应继续下去,最终碳酸钙完全溶解;
C.以及电解原理,粗铜做阳极发生氧化反应,精铜做阴极,铜离子在阴极上发生还原反应生成铜析出;
D.依据反应能否自发进行的判据:△H-T△S解答.
B.碳酸钙和硫酸反应生成一种微溶物质硫酸钙,覆盖在碳酸钙表面隔绝了碳酸钙与硫酸的继续反应;碳酸钙和醋酸反应生成一种易溶于水的物质醋酸钙,碳酸钙消耗醋酸产生氢离子,促进醋酸电离平衡右移,使反应继续下去,最终碳酸钙完全溶解;
C.以及电解原理,粗铜做阳极发生氧化反应,精铜做阴极,铜离子在阴极上发生还原反应生成铜析出;
D.依据反应能否自发进行的判据:△H-T△S解答.
解答:解:A.升高温度促进水的电离,所以60℃时水电离产生的氢离子浓度大于25℃水电离产生的氢离子浓度,60℃时纯水的pH值低,故A错误;
B.碳酸钙和醋酸反应生成易溶于水的醋酸钙,所以能完全溶解在醋酸中,故B错误;
C.电解法精炼铜时,以粗铜作阳极,纯铜作阴极,故C错误;
D.反应能自发进行说明:△H-T△S<0,由方程式NH3(g)+HCl(g)═NH4Cl(s)可知该反应的<0,要使:△H-T△S<0,所以必须满足△H<0,故D正确.
故选D.
B.碳酸钙和醋酸反应生成易溶于水的醋酸钙,所以能完全溶解在醋酸中,故B错误;
C.电解法精炼铜时,以粗铜作阳极,纯铜作阴极,故C错误;
D.反应能自发进行说明:△H-T△S<0,由方程式NH3(g)+HCl(g)═NH4Cl(s)可知该反应的<0,要使:△H-T△S<0,所以必须满足△H<0,故D正确.
故选D.
点评:本题考查了弱电解质电离平衡的影响因素,电解池原理,反应进行方向的判断,属于基本知识的考查,题目难度不大,注意D选项.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
 (2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )
(2012?绵阳模拟)钾在氧气中燃烧时得到一种钾的氧化物晶体,其结构如图所示,下列有关说法正确的是( )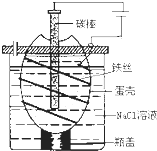 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置, (2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.
(2009?上海)海洋是资源的宝库,蕴藏着丰富的化学元素,如氯、溴、碘等.