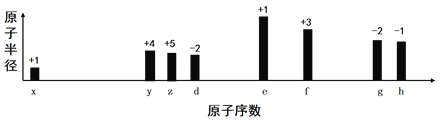
题目内容
【题目】下图表示的是A-E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。试推出各物质的化学式,并写出B→C、C→D、D→E、A→C反应的离子方程式。
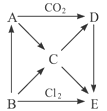
(1)A B C D
(2)B→C
(3)C→D
(4)D→E
(5)A→C
【答案】(1)Na2O2;Na;NaOH;Na2CO3;
(2)2Na+2H2O![]() 2Na++2OH-+H2↑;
2Na++2OH-+H2↑;
(3)2OH-+CO2![]() CO32-+H2O;
CO32-+H2O;
(4)CO32-+2H+![]() CO2↑+H2O;
CO2↑+H2O;
(5)2Na2O2+2H2O=4Na++4OH-+O2↑。
【解析】
试题分析:(1)A为淡黄色物质,淡黄色物质一般有S、Na2O2、AgBr,A能和CO2反应,说明A为Na2O2,A和CO2反应生成Na2CO3和O2,D为化合物,因此D为Na2CO3,B为单质,B能生成Na2O2,B可能是Na,也可能是O2,B和Cl2反应生成E,因此B为Na,E为NaCl,C为NaOH;(2)2Na+2H2O=2NaOH+H2↑,离子反应式为2Na+2H2O=2Na++2OH-+H2↑;(3)2NaOH+CO2=Na2CO3+H2O,离子反应式为2OH-+CO2=CO32-+H2O;(4)Na2CO3+2HCl=2NaCl+CO2↑+H2O,其离子反应式为CO32-+2H+=H2O+CO2↑;(5)2Na2O2+2H2O=4NaOH+O2↑,其离子反应方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑。

【题目】某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
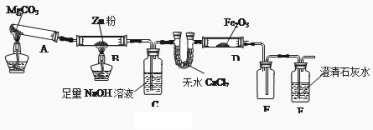
(1)MgCO3的分解产物为 。装置B中的反应方程式为 。
(2)装置C的作用是 ,处理尾气的方法为 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
已知:Fe2+与[Fe(CN)6]3-反应生成Fe3[Fe(CN)6]2(蓝色沉淀)
①乙组得到的黑色粉末是 ;
②甲组步骤1中反应的离子方程式为 ;
③从实验安全考虑,上图装置还可采取的改进措施是 ;
④乙组步骤4中,溶液变红的原因为 ;溶液褪色可能的原因是 ,其验证方法为 。