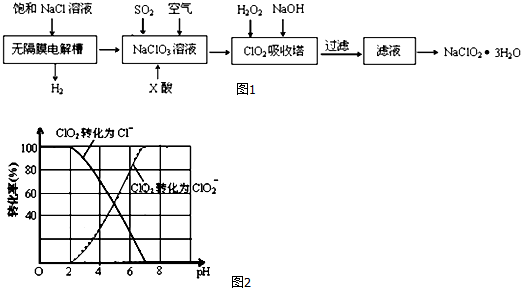
题目内容
7.发射火箭时用肼(N2H4)作燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水.已知32gN2H4(g)完全发生上述反应放出568kJ的热量,热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ•mol-1.
分析 根据n=$\frac{m}{M}$计算32gN2H4的物质的量,再根据热化学方程式书写原则书写热化学方程式.
解答 解:32gN2H4的物质的量为$\frac{32g}{32g/mol}$=1mol,与二氧化氮反应生成氮气与气态水放出568kJ的热量,热化学方程式是:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ•mol-1;
故答案为:2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1136kJ•mol-1.
点评 考查热化学方程式的书写、反应热的有关计算等,难度不大,这部分的试题要注意理解盖斯定律的内涵并灵活应用.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
15.一定量的Na、Mg、Al分别与足量的盐酸反应,放出氢气的质量之比为1:2:4,则Na、Mg、Al三种金属的物质的量之比为( )
| A. | 1:1:1 | B. | 4:2:1 | C. | 2:3:4 | D. | 3:3:4 |
12.85岁中国女药学家屠呦呦因创制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖.颁奖理由是“因为发现青蒿素--一种用于治疗疟疾的药物,挽救了全球特别是发展中国家的数百万人的生命.”请回答下列问题.

(1)关于青蒿素和双氢青蒿素(结构如图)的下列说法,错误的是D
A.青蒿素的分子式为C15H22O5
B.由青蒿素制备双氢青蒿素的反应属于还原反应
C.青蒿素分子中含有过氧链和酯基、醚键
D.双氢青蒿素分子中有2个六元环和2个七元环
(2)水煎青蒿治疗疟疾,药性很不稳定,效果很差.屠呦呦改用乙醇控温60℃,药效显著提高,这说明青蒿素的性质可溶于乙醇、对热不稳定.
(3)经过190次提取失败后,1971年屠呦呦用一种更适宜的物质从青蒿中提取青蒿素,这种提取物对疟原虫的抑制率达到了100%,这种适宜的物质是D(填如表中的编号).
(4)上述用水、乙醇等从植物青蒿中提取青蒿素的方法属于固-液萃取法(或萃取法).

(1)关于青蒿素和双氢青蒿素(结构如图)的下列说法,错误的是D
A.青蒿素的分子式为C15H22O5
B.由青蒿素制备双氢青蒿素的反应属于还原反应
C.青蒿素分子中含有过氧链和酯基、醚键
D.双氢青蒿素分子中有2个六元环和2个七元环
(2)水煎青蒿治疗疟疾,药性很不稳定,效果很差.屠呦呦改用乙醇控温60℃,药效显著提高,这说明青蒿素的性质可溶于乙醇、对热不稳定.
(3)经过190次提取失败后,1971年屠呦呦用一种更适宜的物质从青蒿中提取青蒿素,这种提取物对疟原虫的抑制率达到了100%,这种适宜的物质是D(填如表中的编号).
| A | B | C | D | |
| 物质 | 煤油 | 丙醇 | 四氯化碳 | 乙醚 |
| 沸点/℃ | 180~310℃ | 97.4 | 76.5 | 34.5 |
19.除去括号内杂质的试剂或方法错误的是( )
| A. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 | |
| D. | C2H5OH(CH3COOH),加足量CaO,蒸馏 |
16.A、B、C、D、E、F六种化合物,其中A、B、C、D、E均由短周期元素组成,焰色反应均为黄色,B、C、E均由三种元素组成.B、C的组成元素相同,且C的摩尔质量比B大80g/mol,回答:
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
写出B与稀H2SO4反应的离子方程式S2O32-+2H+=S↓+SO2↑+H2O,
写出②中反应方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子)、XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为2.5mol
(4)化合物D和E相互转化D$?_{CO_{2}+H_{2}O}^{△}$ E,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
(1)固体化合物A为浅黄色粉末,该化合物中含有的化学键为AC
A、离子键 B、极性共价键 C、非极性共价键 D、氢键
(2)下表为B与F实验的部分内容
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
写出②中反应方程式FeCl3+3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3HCl;
(3)现由6种粒子Mn2+、MnO4-、H+、H2O、X2Y82-(C中含有的阴离子)、XY42-完成一个离子方程式,已知Mn2+为还原剂,得到1mol MnO4-需氧化剂的物质的量为2.5mol
(4)化合物D和E相互转化D$?_{CO_{2}+H_{2}O}^{△}$ E,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
17.用水稀释0.1mol/L一元弱酸HX时,溶液中随着水量的增加而增大的是( )
| A. | c(H+) | B. | c(X-) | C. | $\frac{c({H}^{+})}{c(HX)}$ | D. | $\frac{c(HX)}{c({H}^{+})}$ |
 W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.
W、X、Y、Z四种短周期元素在周期表中的位置如图1所示,其中Y与钠元素和氢元素均可形成原子个数1:1和1:2的化合物.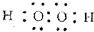 ,Z在周期表中的位置第三周期ⅦA族.
,Z在周期表中的位置第三周期ⅦA族.