题目内容
【题目】研究NOx、SO2、CO等大气污染气体的处理方法具有重要意义。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:用CO(g)还原NO2(g)的能量转化关系如图所示。
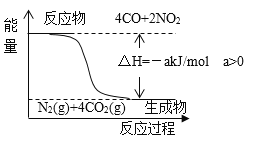
若用标准状况下22.4LCO,还原NO2至N2(CO完全反应)的整个过程中,转移电子的物质的量为_______mol,放出的热量为_______kJ(用含有a的代数式表示)。
(2)用CH4催化还原NOx也可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1molCH4还原NO2至N2和液态水,整个过程中放出的热量为867kJ,则△H2=______。
【答案】 2 a/4 ﹣1160kJ/mol
【解析】(1)发生反应:4CO+2NO2=N2+4CO2,CO物质的量为![]() =1mol,根据C元素化合价变化可知转移电子为1mol×2=2mol;由图可知4mol CO反应时放出热量为a kJ,则0.1mol CO反应放出的热量为a kJ×
=1mol,根据C元素化合价变化可知转移电子为1mol×2=2mol;由图可知4mol CO反应时放出热量为a kJ,则0.1mol CO反应放出的热量为a kJ×![]() =0.25a kJ;
=0.25a kJ;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJmol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×![]() 可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJmol-1,则(-574KJmol-1+△H2)×
可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJmol-1,则(-574KJmol-1+△H2)×![]() =-867KJmol-1,解得△H2=-1160KJ/mol.
=-867KJmol-1,解得△H2=-1160KJ/mol.