题目内容
(8分)为除去粗盐中的Ca2+、Mg2+ 、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):

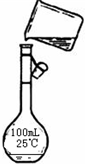
(1)步骤②中应加入的试剂是 溶液,判断此试剂已加过量的方法是 。
(2)步骤④中应加入的试剂是 溶液,第④步中相关的离子方程式是 。
(3)若将第⑤步和第⑥步颠倒,会对实验结果产生影响,其原因是 。
(8分)(1)BaCl2 。(1分)取少量上层澄清液于试管中,滴加氯化钡溶液,不再产生白色沉淀,证明氯化钡溶液已滴加过量。 或取少量上层澄清液于试管中,滴加稀硫酸,产生白色沉淀,证明氯化钡溶液已滴加过量。 (2分,其他合理答案均可给分)
(2)Na2CO3。(1分) Ca2+ + CO32- = CaCO3↓ (1分) Ba2+ + CO32- = BaCO3↓ (1分)
(3)会使CaCO3、BaCO3、Mg(OH)2沉淀溶解,重新引入Ca2+、Ba2+、Mg2+。(2分)
【解析】在提纯过程中首先①溶解、过滤除去不溶性泥沙等杂质;而Ca2+、Mg2+ 、SO42-分别用Na2CO3、NaOH、BaCl2来除去,并且一定要先加入BaCl2,再加入Na2CO3以除去新引入的钡离子。
(1)步骤②中应加入的试剂是BaCl2;验证其过量一般是取上层清液,继续加入试剂或验证里面是否含有Ba2+
(2)步骤④中应加入的试剂是Na2CO3,它有两个作用:分别沉淀Ca2+ 及新引入的Ba2+
(3)先过滤会前功尽弃,使生成的沉淀又溶解,重新引入杂质离子。



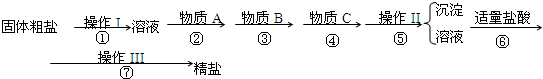
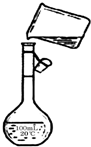
 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):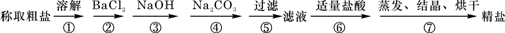

 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液