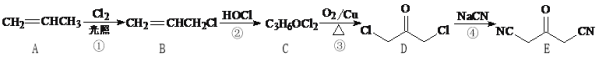题目内容
【题目】SO2、NO是大气污染物。吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):
(1)装置Ⅰ中生成HSO3-的离子方程式为_____ 。
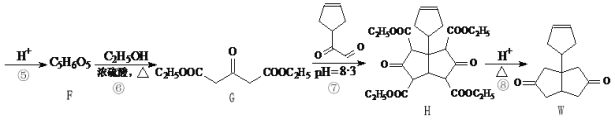
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。
①下列说法正确的是_____(填字母序号)。
A.pH=8时,溶液中c(HSO3-) <c(SO32-)
B.pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C.为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:_____。
(3)装置Ⅱ中,酸性条件下,NO被Ce4+氧化的产物主要是NO3-、NO2-,写出生成NO3-的离子方程式____。
(4)装置Ⅲ的作用之一是再生Ce4+,其原理如图所示。

①生成Ce4+的电极反应式为_________。
②生成Ce4+从电解槽的_____(填字母序号)口流出。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g/L,要使1m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2___L。(用含a代数式表示,计算结果保留整数)
【答案】SO2+OH-=HSO3- A、C HSO3-在溶液中存在电离平衡:HSO3-![]() H++SO32-,加入CaCl2溶液后,Ca2++SO32-=CaSO3,使电离平衡右移,c(H+)增大 NO+2H2O+3Ce4+=3Ce3++NO3-+4H+ Ce3+-e-=Ce4+ a 243a(242a、244a、
H++SO32-,加入CaCl2溶液后,Ca2++SO32-=CaSO3,使电离平衡右移,c(H+)增大 NO+2H2O+3Ce4+=3Ce3++NO3-+4H+ Ce3+-e-=Ce4+ a 243a(242a、244a、![]() )
)
【解析】
(1)二氧化硫是酸性氧化物,能和强碱氢氧化钠之间发生反应:SO2+OH-=HSO3-,NO和氢氧化钠之间不会反应;
(2)①A. pH=8时,根据图示得到的是亚硫酸钠和亚硫酸氢钠的混合物,根据离子的水解程度不同分析离子浓度大小;
B. 根据溶液中的电荷守恒分析;
C. 依据图像分析;
②依据钙离子对亚硫酸氢根离子电离平衡的影响效果作答;
(3)在酸性环境中,一氧化氮和Ce4+之间会发生氧化还原反应;
(4)Ce3+失电子被氧化生成Ce4+,在电解槽中阳极上失电子;电解过程中溶液中的阳离子从a口流出;
(5)依据得失电子守恒作答。
(1)过量的二氧化硫与氢氧化钠溶液反应生成亚硫酸氢根离子,离子方程式为SO2 + OH-=HSO3-;
(2)①B. pH=8时,根据图示得到的溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序为:c(Na+)> c(SO32-)>c(HSO3-)> c(OH-)> c(H+),所以c(HSO3-) <c(SO32-),A项正确;
B. pH=7时,溶液为中性,氢离子浓度与氢氧根离子浓度相等,则c(Na+)+ c(H+)=2c(SO32-)+c(HSO3-)+ c(OH-),则推出c(Na+)=c(HSO3-) +2c(SO32-),B项错误;
C. 溶液的pH控制在4~5时,c(HSO3-)浓度最大,则为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,C项正确。
所以答案选A、C。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,是因为亚硫酸氢钠溶液中存在电离平衡:HSO3-![]() SO32-+H+,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
SO32-+H+,加入CaCl2溶液后,Ca2++SO32-=CaSO3↓,使亚硫酸根离子的浓度减小,电离平衡右移,c(H+)增大,pH减小;
(3)在酸性环境中,Ce4+将NO氧化为硝酸根离子,依据氧化还原反应规律可知其反应的离子方程式为:NO + 2H2O + 3Ce4+=3Ce3+ + NO3- + 4H+;
(4)①生成Ce4+为氧化反应,发生在阳极上,因此再生时生成的Ce4+在电解槽的阳极,其电极反应式为Ce3+-e-=Ce4+;
②生成Ce4+从电解槽的a口流出;
(5)溶液中的NO2-完全转化为NH4NO3,根据流程图可知装置Ⅳ中加入了氨气和氧气,因此NO2-被氧气氧化生成NO3-,氮元素化合价由+3价升高到+5价,氧气中氧元素由0价降低到-2价,根据得失电子守恒可知两者反应的关系式为:2NO2-~O2,n(NO2-)=![]() ,则需氧气的物质的量为:n(O2)=
,则需氧气的物质的量为:n(O2)=![]() n(NO2-)=
n(NO2-)=![]() ,其标准状况下的体积为:
,其标准状况下的体积为:![]() ×22.4L/mol=
×22.4L/mol=![]()
![]() 243a(或242a、244a、
243a(或242a、244a、![]() )。
)。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案【题目】(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
实验序号 | 金属质量/g | 金属状态 | c(H2SO4)/molL-1 | V(H2SO4)/mL | 反应前溶液温度/℃ | 金属消失的时间/s |
1 | 0.10 | 丝 | 0.5 | 50 | 20 | 500 |
2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 50 |
3 | 0.10 | 丝 | 1.0 | 50 | 20 | 125 |
4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 |
对比实验1和3,表明影响化学反应速率的因素是___;此外,该实验表明影响化学反应速率的因素还有___。
(2)用如图原电池装置可加快铁与稀硫酸反应的速率,其中铜作___(填“负极”或“正极”),铁的电极反应式是___。

(3)举出生活中你熟悉的一种二次电池___。