题目内容
有关下列装置或操作说法错误的是
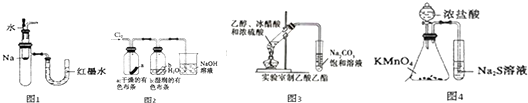
- A.图1中:将胶头滴管中的水滴入到金属钠中,能看到U型管右侧红墨水上升
- B.图2中:观察到湿润的有色布条能褪色,待尾气全部被碱吸收后,将稀硫酸滴入烧杯中,至溶液显酸性,可能看到有黄绿色气体生成
- C.图3可用于制备乙酸乙酯
- D.图4可以比较KMnO4、Cl2、和S氧化性的相对强弱
C
分析:A.Na与水的反应为放热反应,大试管中气体体积增大;
B.HClO具有漂白性,氯气与NaOH反应生成NaCl、NaClO和水,酸性条件下发生氧化还原反应生成Cl2;
C.盛饱和碳酸钠的溶液中的导管应在液面以上;
D.浓盐酸与高锰酸钾反应生成氯气,氯气与硫化钠反应生成S.
解答:A.Na与水的反应为放热反应,大试管中气体体积增大,则能看到U型管右侧红墨水上升,故A正确;
B.HClO具有漂白性,观察到湿润的有色布条能褪色,氯气与NaOH反应生成NaCl、NaClO和水,酸性条件下发生氧化还原反应生成Cl2,则至溶液显酸性,可能看到有黄绿色气体生成,故B正确;
C.乙酸乙酯的制备,应注意防止倒吸,所以盛饱和碳酸钠的溶液中的导管应在液面以上,而图中在液面以下,故C错误;
D.浓盐酸与高锰酸钾反应生成氯气,氯气与硫化钠反应生成S,由氧化剂的氧化性大于氧化产物的氧化性,则可以比较KMnO4、Cl2、和S氧化性的相对强弱,故D正确;
故选C.
点评:本题考查化学实验方案的评价,涉及氧化还原反应及其能量变化、乙酸乙酯的制备、氧化性的比较等,选项B中酸性条件下的氧化还原为解答的难点,题目难度中等.
分析:A.Na与水的反应为放热反应,大试管中气体体积增大;
B.HClO具有漂白性,氯气与NaOH反应生成NaCl、NaClO和水,酸性条件下发生氧化还原反应生成Cl2;
C.盛饱和碳酸钠的溶液中的导管应在液面以上;
D.浓盐酸与高锰酸钾反应生成氯气,氯气与硫化钠反应生成S.
解答:A.Na与水的反应为放热反应,大试管中气体体积增大,则能看到U型管右侧红墨水上升,故A正确;
B.HClO具有漂白性,观察到湿润的有色布条能褪色,氯气与NaOH反应生成NaCl、NaClO和水,酸性条件下发生氧化还原反应生成Cl2,则至溶液显酸性,可能看到有黄绿色气体生成,故B正确;
C.乙酸乙酯的制备,应注意防止倒吸,所以盛饱和碳酸钠的溶液中的导管应在液面以上,而图中在液面以下,故C错误;
D.浓盐酸与高锰酸钾反应生成氯气,氯气与硫化钠反应生成S,由氧化剂的氧化性大于氧化产物的氧化性,则可以比较KMnO4、Cl2、和S氧化性的相对强弱,故D正确;
故选C.
点评:本题考查化学实验方案的评价,涉及氧化还原反应及其能量变化、乙酸乙酯的制备、氧化性的比较等,选项B中酸性条件下的氧化还原为解答的难点,题目难度中等.

练习册系列答案
相关题目
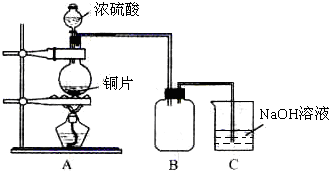
 某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:
某课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验: