题目内容
(6分)将4 mol SO2和2 mol O2气体在2L的容器中混合,在一定条件下发生如下反应:2SO2(g)+O2 (g) 2SO3 (g)若经过2s后测得SO3的浓度为0.6 mol/ L,试计算:
2SO3 (g)若经过2s后测得SO3的浓度为0.6 mol/ L,试计算:
小题1:v(O2);
小题2:SO2的转化率;
小题3:2s时的O2浓度。
 2SO3 (g)若经过2s后测得SO3的浓度为0.6 mol/ L,试计算:
2SO3 (g)若经过2s后测得SO3的浓度为0.6 mol/ L,试计算:小题1:v(O2);
小题2:SO2的转化率;
小题3:2s时的O2浓度。
小题1:0.15mol/(L·s);
小题1:30%;
小题1:0.7mol/L
考查可逆反应的应该计算。在可逆反应的计算中往往采用三段式,即分别列出起始量、转化量、平衡(或某时刻)量,然后根据条件列式计算即可。
反应式为 2SO2(g)+O2 (g) 2SO3 (g)
2SO3 (g)
起始量(mol) 4 2 0
转化量(mol) 1.2 0.6 1.2
2s后(mol) 2.8 1.4 1.2
(1)用氧气表示的反应速率为
(2)SO2的转化率为
(3)2s时的O2浓度为
反应式为 2SO2(g)+O2 (g)
 2SO3 (g)
2SO3 (g)起始量(mol) 4 2 0
转化量(mol) 1.2 0.6 1.2
2s后(mol) 2.8 1.4 1.2
(1)用氧气表示的反应速率为

(2)SO2的转化率为

(3)2s时的O2浓度为


练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 3C(g)+D(g)达到平衡状态的标志是( )
3C(g)+D(g)达到平衡状态的标志是( )
 pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时, 能说明达到平衡状态的标志是
pC(g) + qD(g),当m、n、p、q为任意整数(不为零)时, 能说明达到平衡状态的标志是 C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )
C(g) +D(g) 发生过程中的能量变化如图,△H表示反应的焓变。下列说法正确的是( )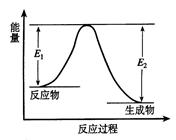
 2SO3(正反应放热),判断该反应达到平衡状态的标志是
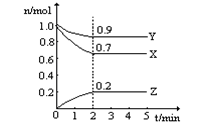
2SO3(正反应放热),判断该反应达到平衡状态的标志是 Y(g)+2Z(g),△H>0,在某温度时X的浓度随时间变
Y(g)+2Z(g),△H>0,在某温度时X的浓度随时间变