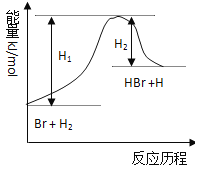
题目内容
【题目】氮及其化合物在工农业生产中具有重要作用.
(1)某小组进行工业合成氨![]() 的模拟研究,在1L密闭容器中,分别加入0.1molN2和0.3molH2,实验
的模拟研究,在1L密闭容器中,分别加入0.1molN2和0.3molH2,实验![]() 、
、![]() 、
、![]() 中
中![]() 随时间
随时间![]() 的变化如图所示.
的变化如图所示.
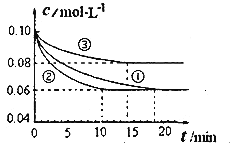
实验![]() 从开始到达到平衡状态的过程中,用
从开始到达到平衡状态的过程中,用![]() 表示的平均反应速率为 ___________.与实验
表示的平均反应速率为 ___________.与实验![]() 相比.实验
相比.实验![]() 所采用的实验条件可能为 ___________
所采用的实验条件可能为 ___________![]() 填字母
填字母![]() ,实验
,实验![]() 所采用的实验条件可能为 ___________
所采用的实验条件可能为 ___________![]() 填字母
填字母![]() .
.
![]() 增大压强
增大压强 ![]() 减小压强
减小压强 ![]() 升高温度
升高温度 ![]() 降低温度
降低温度 ![]() 使用催化剂
使用催化剂
(2)![]() 可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+ NO(g)+ NO2(g)
可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+ NO(g)+ NO2(g)![]() 2N2(g)+ 3H2O(g) △H<0,欲提高废气中氮氧化物的转化率,可采取的措施是 ___________
2N2(g)+ 3H2O(g) △H<0,欲提高废气中氮氧化物的转化率,可采取的措施是 ___________![]() 填字母
填字母![]()
![]() 升高温度
升高温度 ![]() 增大压强 c,增大
增大压强 c,增大![]() 的浓度
的浓度
(3)![]() 遇水发生水解反应,生成
遇水发生水解反应,生成![]() 的同时得到 ___________
的同时得到 ___________![]() 填化学式
填化学式![]() 是广谱高效消毒剂,制备原理为
是广谱高效消毒剂,制备原理为![]() 若转移1mol电子,则制取
若转移1mol电子,则制取![]() 的质量为 ___________.
的质量为 ___________.
(4)![]() 时,将
时,将![]() 的氨水与
的氨水与![]() 盐酸等体积混合,反应后溶液恰好显中性,则a ___________
盐酸等体积混合,反应后溶液恰好显中性,则a ___________![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 用a、b表示
用a、b表示![]() 的电离平衡常数为 ___________.
的电离平衡常数为 ___________.
【答案】0.012mol/(L·min) ![]()
![]()
![]()
![]()
![]()
![]()
![]()
【解析】
![]() 由图可知,实验
由图可知,实验![]() 到达平衡,平衡时△c(N2)=0.1mol/L-0.06mol/L=0.04mol/L,再根据方程式计算
到达平衡,平衡时△c(N2)=0.1mol/L-0.06mol/L=0.04mol/L,再根据方程式计算![]() ,根据
,根据![]()
![]() 计算
计算![]() ;
;
由图可知,与实验![]() 相比,实验
相比,实验![]() 到达平衡所以时间较短,反应速率较快,但平衡时氮气的浓度不变,改变条件平衡不移动,该反应正反应是气体体积减小的反应,故实验
到达平衡所以时间较短,反应速率较快,但平衡时氮气的浓度不变,改变条件平衡不移动,该反应正反应是气体体积减小的反应,故实验![]() 应是使用催化剂;
应是使用催化剂;
由图可知,与实验![]() 相比,实验
相比,实验![]() 到达平衡所以时间较短,反应速率较快,平衡时氮气的浓度增大,改变体积平衡向逆反应移动,据此结合选项判断;
到达平衡所以时间较短,反应速率较快,平衡时氮气的浓度增大,改变体积平衡向逆反应移动,据此结合选项判断;
![]() 提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,结合平衡移动原理分析;
提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,结合平衡移动原理分析;
![]() 遇水发生水解反应,
遇水发生水解反应,![]() 分子中负价原子结合水电离的氢离子,正价原子结合水电离的去氢根离子,据此判断双键产物; 根据得失电子守恒判断计算;
分子中负价原子结合水电离的氢离子,正价原子结合水电离的去氢根离子,据此判断双键产物; 根据得失电子守恒判断计算;
![]() 溶液显中性,所以
溶液显中性,所以![]() ,溶液的电荷守恒可得:
,溶液的电荷守恒可得:![]() ,故
,故![]() ,氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量;
,氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量;
电常数只与温度有关,结合电离常数Kb的表达式计算。
![]() 由图可知,实验
由图可知,实验![]() 到达平衡,平衡时△c(N2)=0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知,
到达平衡,平衡时△c(N2)=0.1mol/L-0.06mol/L=0.04mol/L,由方程式可知,![]() ,故
,故![]()
![]()
![]() ,
,
由图可知,与实验![]() 相比,实验
相比,实验![]() 到达平衡所以时间较短,反应速率较快,但平衡时氮气的浓度不变,改变条件平衡不移动,该反应正反应是气体体积减小的反应,故实验
到达平衡所以时间较短,反应速率较快,但平衡时氮气的浓度不变,改变条件平衡不移动,该反应正反应是气体体积减小的反应,故实验![]() 应是使用催化剂,
应是使用催化剂,
由图可知,与实验![]() 相比,实验
相比,实验![]() 到达平衡所以时间较短,反应速率较快,平衡时氮气的浓度增大,改变体积平衡向逆反应移动,该反应正反应是体积减小的放热反应,故为升高温度;
到达平衡所以时间较短,反应速率较快,平衡时氮气的浓度增大,改变体积平衡向逆反应移动,该反应正反应是体积减小的放热反应,故为升高温度;
故答案为:![]() ;e;c;
;e;c;
![]() 提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,
提高废气中氮氧化物的转化率,应改变条件使平衡向正反应移动,
![]() 该反应正反应是放热反应,升高温度,平衡向逆反应移动,氮氧化物的转化率降低,故a错误;
该反应正反应是放热反应,升高温度,平衡向逆反应移动,氮氧化物的转化率降低,故a错误;
![]() 该反应正反应是体积增大的反应,增大压强,平衡向逆反应移动,氮氧化物的转化率降低,故b错误;
该反应正反应是体积增大的反应,增大压强,平衡向逆反应移动,氮氧化物的转化率降低,故b错误;
![]() 增大
增大![]() 的浓度,平衡向正反应移动,氮氧化物的转化率增大,故c正确;
的浓度,平衡向正反应移动,氮氧化物的转化率增大,故c正确;
故答案为:c;
![]() 遇水发生水解反应,
遇水发生水解反应,![]() 分子中负价原子结合水电离的氢离子,正价原子结合水电离的去氢根离子,故生成
分子中负价原子结合水电离的氢离子,正价原子结合水电离的去氢根离子,故生成![]() 的同时还得到HClO;反应中
的同时还得到HClO;反应中![]() 中的Cl元素化合价由
中的Cl元素化合价由![]() 价升高为
价升高为![]() 中
中![]() 价,故转移1mol电子,生成
价,故转移1mol电子,生成![]() 的物质的量为1mol,质量为
的物质的量为1mol,质量为![]() ,
,
故答案为:HClO;![]() ;
;
![]() 溶液显中性,所以
溶液显中性,所以![]() ,溶液的电荷守恒可得:
,溶液的电荷守恒可得:![]() ,故
,故![]() ,氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸;溶液中
,氯化铵是强酸弱碱盐其水溶液呈酸性,要使氯化铵溶液呈中性,则氨水应稍微过量,因为盐酸和氨水的体积相等,则氨水的物质的量浓度大于盐酸;溶液中![]() ,
,![]()
![]()
![]() ,c(NH3·H2O)=(
,c(NH3·H2O)=(![]() )mol/L,电离常数只与温度有关,则此时
)mol/L,电离常数只与温度有关,则此时![]() 的电离常数Kb=
的电离常数Kb= =
=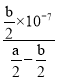 =
=![]() , 故答案为:
, 故答案为:![]() ,
,![]() 。
。

【题目】I.配制250mL0.5mol/L的NaOH溶液,所需的仪器有烧杯、玻璃棒、托盘天平、胶头滴管和_______。定容时俯视观察刻度线,其结果_______。(填“偏大”、“偏小”、或“不变”)
Ⅱ.实验室用加热固体氯化铵和氢氧化钙的混合物制取氨气,反应的化学方程式是_______;所制得的气体中常含有少量杂质气体,为了得到纯净的氨气并加以检验,请在下列装置或试剂中,根据要求作出合适选择,并将对应选择的装置编号字母填入表中的空格处:
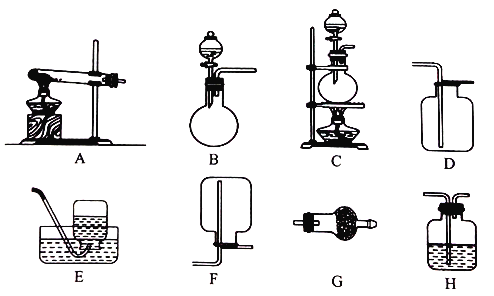
试剂:a. NaOH溶液 b.澄清石灰水 c.浓硫酸 d.饱和NaHCO3溶液 e.碱石灰
f.品红溶液 g.湿润的红色石蕊试纸
制取气体 | 杂质气体 | 制取气体的 发生装置 | 收集装置 | 净化装置中 所用的试剂 | 检验制得的气体 所用试剂 |
NH3 | H2O(g) | _______ | F | e | _______ |