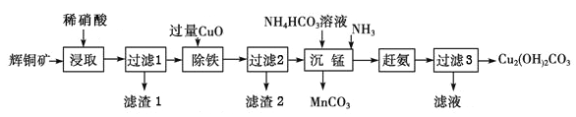
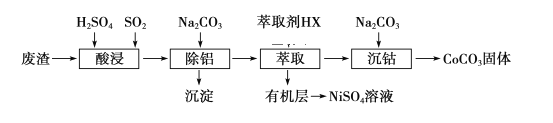
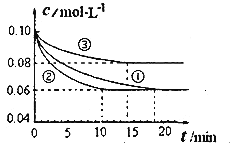
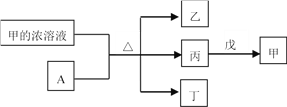
题目内容
【题目】向盛有5 mL 0.01 mol/L的硫氰化钾溶液的小烧杯中,加入5 mL0.01 mol/L的FeCl3溶液,混合液立即__________。写出上述反应的离子方程式_____________。向以上溶液中再加0.1 mol/L NaOH溶液至过量,其现象是__________,写出发生上述现象的反应离子方程式_____________。
【答案】变红 3SCN-+Fe3+Fe(SCN)3 溶液红色褪去,并有红褐色沉淀生成 Fe(SCN)3+3OH-=Fe(OH)3↓+3SCN-
【解析】
Fe3+可以和SCN-发生络合反应生成Fe(SCN)3,该络合物呈红色,向含有该络合物的溶液中加入过量的NaOH溶液,OH-可以和络合物中的Fe3+发生反应生成沉淀。
根据分析,向KSCN溶液中加入FeCl3溶液,发生如下反应3SCN-+Fe3+![]() Fe(SCN)3,溶液立即变成血红色;再向含有Fe(SCN)3的溶液中加入NaOH,溶液颜色变浅至无色,同时生成红褐色沉淀,反应方程式为Fe(SCN)3+3OH-=Fe(OH)3↓+3SCN-。
Fe(SCN)3,溶液立即变成血红色;再向含有Fe(SCN)3的溶液中加入NaOH,溶液颜色变浅至无色,同时生成红褐色沉淀,反应方程式为Fe(SCN)3+3OH-=Fe(OH)3↓+3SCN-。

练习册系列答案
相关题目