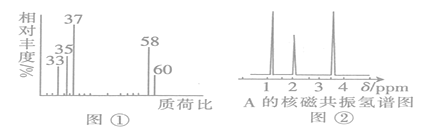
题目内容
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在, CrO42-和Cr2O72-在溶液中可相互转化2CrO42-+2H+![]() Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
Cr2O72-+H2O。 室温下,初始浓度为1.0mol/L的Na2CrO4溶液中c(Cr2O72-)随c(H+)的变化如图所示,回答下列问题:
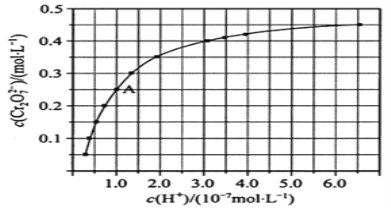
(1)由图可知,随着溶液酸性增强,CrO42-的平衡转化率__________(填“增大“减小”或“不变”)。根据A(1.0,0.25)点数据,计算出该转化反应的平衡常数为__________。
(2)升高温度,溶液中CrO42-的平衡转化率减小,则该反应的ΔH_______0(填“大于”“小于”或“等于”)。
(3) 在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与CrO42-生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好完全沉淀(浓度等于1.0×10-5mol/L)时,溶液中c(Ag+)为_______ mol/L,此时溶液中c(CrO42-)等于__________ mol/L。 (已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)。
【答案】增大 1.0×1014 小于 2.0×10-5 5.0×10-3
【解析】
(1)根据图示中c(H+)与c(Cr2O72-)的关系分析;A点时溶液的c(H+)=1×10-7mol/L,Cr2O72-的浓度为0.25mol/L,结合反应方程式及平衡常数的含义计算K值大小;
(2)根据升高温度,化学平衡向吸热反应方向移动分析;
(3)依据Ksp(AgCl)=c(Ag+)·c(Cl-)及c(Cl-)=1.0×10-5mol/L计算c(Ag+),然后根据Ksp(Ag2CrO4)= c2(Ag+)·c(CrO42-)再进行计算c(CrO42-)。
(1)由图可知,随着溶液的酸性增强,c(Cr2O72-)的浓度增大,故铬酸根离子的平衡转化率增大;
A点时溶液的c(H+)=1×10-7mol/L,c(Cr2O72-)=0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,此时该转化反应的平衡常数为K=![]() =
=![]() =1.0×1014;
=1.0×1014;
(2)根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由于升高温度后CrO42-的平衡转化率减小,说明平衡向逆反应方向移动,则逆反应为吸热反应,因此该反应的正反应为放热反应,所以△H<0;
(3)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=![]() =
=![]() =2.0×10-5mol/L;此时溶液中c(CrO42-)=
=2.0×10-5mol/L;此时溶液中c(CrO42-)=![]() =5.0×10-3mol/L。
=5.0×10-3mol/L。

【题目】根据下列实验和现象,所得实验结论正确的是( )
选项 | 实验 | 现象 | 实验结论 |
A | 向某溶液中先滴加适量稀硝酸,再滴加少量BaCl2溶液 | 出现白色沉淀 | 原溶液中含有SO42-、SO32-、HSO3-中的一种或几种 |
B | 向装有Fe(NO3)2溶液的试管中加入稀硫酸 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
C |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
D | SO2和SO3混合气体通入Ba(NO3)2溶液 | 出现白色沉淀 | 得到的沉淀只有BaSO4 |
A. A B. B C. C D. D