题目内容
9.A、B、C、D四种短周期元素原子序数依次增大,它们的原子半径按B、C、D、A顺序依次减小,且质子数之间的关系如下:d=2a,a+d=b+c,请回答下列问题:(1)元素B在元素周期表的位置是第三周期,第IA族,制备其单质可采用电解熔融的NaCl(填化学式);
(2)B、C、D三种元素形成的最高价氧化物的水化物中,酸性最强的是H2SO4,A和D两种元素形成的气态氢化物中,较稳定的是H2O(填化学式);
(3)写出C单质与Cu0在高温下反应的化学方程式2Al+3CuO$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3.
分析 A、B、C、D四种短周期元素原子序数依次增大,D与A不能为第一周期元素,它们的原子半径按B、C、D、A顺序依次减小,则A与D不能为同周期元素,二者质子数为d=2a,则二者只能同主族,可推知A为O元素,D为S元素;结合原子序数与原子半径大小,可知B、C为第三周期元素,由于质子数a+d=b+c,则B、C质子数之和为8+16=24,可推知B为Na、C为Al,据此解答.
解答 解:A、B、C、D四种短周期元素原子序数依次增大,D与A不能为第一周期元素,它们的原子半径按B、C、D、A顺序依次减小,则A与D不能为同周期元素,二者质子数为d=2a,则二者只能同主族,可推知A为O元素,D为S元素;结合原子序数与原子半径大小,可知B、C为第三周期元素,由于质子数a+d=b+c,则B、C质子数之和为8+16=24,可推知B为Na、C为Al.
(1)B为Na,在元素周期表的位置是第三周期第IA,制备其单质可采用电解熔融的NaCl制备,
故答案为:三、IA;NaCl;
(2)B、C、D三种元素形成的最高价氧化物的水化物分别为NaOH、Al(OH)3、H2SO4,酸性最强的是 H2SO4,由于非金属性O>S,故氢化物稳定性H2O>H2S,
故答案为:H2SO4;H2O;
(3)Al单质与CuO在高温下反应的化学方程式:2Al+3CuO$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3,
故答案为:2Al+3CuO$\frac{\underline{\;高温\;}}{\;}$3Cu+Al2O3.
点评 本题考查结构性质位置关系,侧重对元素周期律与性质分析推理能力的考查,推断元素是解题关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.A、B、C、D、E为原子序数依次增大的短周期元素,其中只有一种是金属元素.A、D元素原子最外层电子数相同,且A和D可形成离子化合物,C2-和D+具有相同的电子数,E元素的最高正化合价与最低负化合价之和为2.由这些元素组成的物质,其组成和结构信息如下表:
请用化学用语回答下列问题:
(1)D+的结构示意图为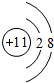 ;
;
(2)C、D、E的氢化物按熔点由高到低排列的顺序为NaH>H2O>PH3;
(3)乙属于极性分子(填“极性”或“非极性”),丁的电子式为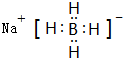 ,
,
(4)将少量甲投入到AlCl3溶液中反应的离子方程式为6Na2O2+4Al3+6H2O=4Al(OH)3↓+3O2↑+12Na+;
(5)氮化硼晶体的熔点要比丙晶体高,其原因是磷原子半径比氮原子大,N-B共价键键长比B-P小,则N-B键能大.
| 物质 | 组成和结构信息 |
| 甲 | 含有非极性共价键的常见二元离子化合物 |
| 乙 | 含有极性键和非极性键的18e-分子 |
| 丙 | 化学组成为BE,熔点高,可作超硬耐磨涂层材料 |
| 丁 | 化学组成为DBA4的离子化合物 |
(1)D+的结构示意图为
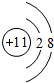 ;
;(2)C、D、E的氢化物按熔点由高到低排列的顺序为NaH>H2O>PH3;
(3)乙属于极性分子(填“极性”或“非极性”),丁的电子式为
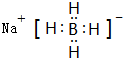 ,
,(4)将少量甲投入到AlCl3溶液中反应的离子方程式为6Na2O2+4Al3+6H2O=4Al(OH)3↓+3O2↑+12Na+;
(5)氮化硼晶体的熔点要比丙晶体高,其原因是磷原子半径比氮原子大,N-B共价键键长比B-P小,则N-B键能大.
20.下列物质的水溶液只存在溶质分子的是( )
| A. | HCl | B. | CH3COOH | C. | 蔗糖 | D. | Na2CO3 |
17.某烷烃的相对分子质量为114,与氯气发生取代反应所得的一氯代物只有一种的是( )
| A. | CH3CH3 | |
| B. |  | |
| C. | 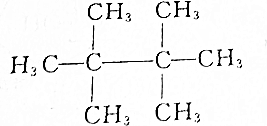 | |
| D. | CH3CH2CH2CH3 |
4.0.3mol O2和0.2mol O3,下列量相等的是( )
①分子数相等
②原子数相等
③质量相等
④摩尔质量相等.
①分子数相等
②原子数相等
③质量相等
④摩尔质量相等.
| A. | ①④ | B. | ③④ | C. | ②③ | D. | ①② |
3.常温下,稀释0.1mol•L-1Na2CO3溶液,图中的纵坐标可以表示( )


| A. | 溶液中HCO3-的数目 | B. | 溶液的pH | ||
| C. | CO32- 水解的平衡常数 | D. | 溶液中的c(CO32-) |
4.Na2O2是一种既有氧化性、又有还原性的物质,当Na2O2与某物质Q发生反应并且有氧气生成时,下列有关说法正确的是( )
| A. | Q一定是氧化剂 | |
| B. | 当有1 mol O2生成时转移电子2 mol | |
| C. | Na2O2只作氧化剂 | |
| D. | Na2O2只作还原剂 |
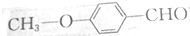 )的同分异构体既能发生银镜反应,又能与FeCl3溶液发生显色反应的有13种.
)的同分异构体既能发生银镜反应,又能与FeCl3溶液发生显色反应的有13种.
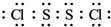 ;
;