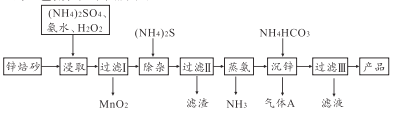
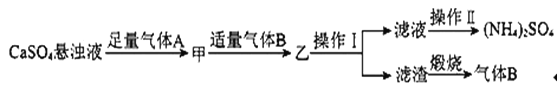
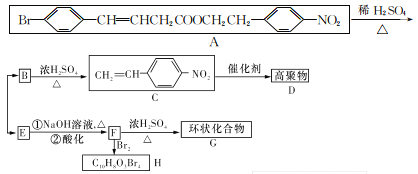
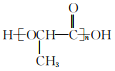题目内容
【题目】【选修3——物质结构与性质】
铁是工业生产中不可缺少的一种金属。请回答下列问题:
(1)Fe元素在元素周期表中的位置是_________________。
(2)Fe有δ、γ、α三种同素异形体,其晶胞结构如下图所示:
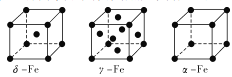
①δ、α两种晶体晶胞中铁原子的配位数之比为_____________。
②1个γ晶体晶胞中所含有的铁原子数为_____________。
③若Fe原子半径为rpm,NA表示阿伏加德罗常数的值,则δ-Fe单质的密度为_____g/cm3(列出算式即可)。
(3)三氯化铁在常温下为固体.熔点为282℃,沸点为315℃,在300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁的晶体类型为__________。
(4)氯化铁溶液用于检验食用香精乙酰乙酸乙酯时,会生成紫色配合物,其配离子结构如图所示。
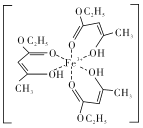
①此配合物中,铁离子的价电子排布式为_________。
②此配合物中碳原子的杂化轨道类型有_______。
③此配离子中含有的化学键有_____(填字母代号)。
A.离子键 B.金属键 C.极性键 D.非极性键
E.配位键 F.氢键 G. δ键 H.π键
【答案】 第四周期第VIII族 4:3 4 ![]() 分子晶体 3d5 sp2杂化、sp3杂化 CDEGH
分子晶体 3d5 sp2杂化、sp3杂化 CDEGH
【解析】(1)Fe元素在周期表中的位置为第四周期第Ⅷ族。(2)①δ、α两种晶胞中铁原子的配位数分别为8、6,则配位数之比为8:6=4:3;②γ晶体晶胞中所含有的铁原子数为8×1/8+6×1/2=4;③δ晶胞为体心立方(堆积),体心立方中含有1+8×1/8=2,体心立方中,体对角线上为三个铁原子相切,则体对角线为4r,晶胞边长为: ![]() ,晶胞体积为:(
,晶胞体积为:(![]() )3,因此密度是
)3,因此密度是 ;(3)三氯化铁晶体的熔沸点较低,易溶于有机溶剂,因此形成的是分子晶体;(4)①铁元素是26号元素,铁原子核外有26个电子,根据构造原理知其基态原子核外电子排布式,铁原子失去3个电子变为铁离子,铁离子核外有23个电子,3d电子为其价电子,铁离子3d能级上有5个电子,4s能级上没有电子,所以其价电子排布式为:3d5;②该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化;③同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键,所以该化合物中碳碳原子之间存在非极性共价键,碳和氧原子或氢原子之间存在极性共价键,铁离子和氧原子之间存在配位键,则该化合物中含有配位键、极性键、非极性键、σ键和π键,答案选CDEGH。
;(3)三氯化铁晶体的熔沸点较低,易溶于有机溶剂,因此形成的是分子晶体;(4)①铁元素是26号元素,铁原子核外有26个电子,根据构造原理知其基态原子核外电子排布式,铁原子失去3个电子变为铁离子,铁离子核外有23个电子,3d电子为其价电子,铁离子3d能级上有5个电子,4s能级上没有电子,所以其价电子排布式为:3d5;②该化合物中连接双键的碳原子含有3个σ键,为sp2杂化,连接4个σ键的碳原子采用sp3杂化;③同种非金属元素之间存在非极性键,不同非金属元素之间存在极性键,含有孤电子对和含有空轨道的原子之间存在配位键,共价单键为σ键,共价双键中含有一个σ键一个π键,所以该化合物中碳碳原子之间存在非极性共价键,碳和氧原子或氢原子之间存在极性共价键,铁离子和氧原子之间存在配位键,则该化合物中含有配位键、极性键、非极性键、σ键和π键,答案选CDEGH。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案