题目内容
15.96g铜与一定浓度的硝酸反应,铜完全溶解生成NO和NO2(不考虑生成N2O4)混合气体33.6L(气体体积均在标准状况下测得).回答下列问题:(1)NO的体积为16.8L.
(2)参加反应的硝酸的物质的量为4.5mol.
(3)若生成的气体完全被水吸收,需要标况下O216.8L.
分析 (1)根据电子转移守恒及NO和NO2的总物质的量列方程计算NO和NO2的物质的量,再根据V=nVm计算NO体积;
(2)参加反应的硝酸生成Cu(NO3)2、NO、NO2,根据N原子守恒计算参加反应的硝酸的物质的量;
(3)NO、NO2与氧气水又反应生成HNO3,根据电子转移守恒可知,Cu失去的电子等于氧气获得的电子,据此计算氧气物质的量,再根据V=nVm计算.
解答 解:(1)Cu的物质的量为$\frac{96g}{64g/mol}$=1.5mol,NO和NO2总物质的量为$\frac{33.6L}{22.4L/mol}$=1.5mol,
设NO和NO2的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{x+y=1.5}\\{3x+y=1.5×2}\end{array}\right.$
解得x=y=0.75
故NO的体积为0.75mol×22.4L/mol=16.8L
故答案为:16.8L;
(2)参加反应的硝酸生成Cu(NO3)2、NO、NO2,则n[Cu(NO3)2]=n(Cu)=1.5mol,根据N原子守恒,参加反应的硝酸的物质的量为1.5mol×2+1.5mol=4.5mol,
故答案为:4.5;
(3)NO、NO2与氧气水又反应生成HNO3,根据电子转移守恒可知,Cu失去的电子等于氧气获得的电子,故消耗氧气物质的量为$\frac{1.5mol×2}{4}$=0.75mol,故需要氧气的体积为0.75mol×22.4L/mol=16.8L,
故答案为:16.8.
点评 本题考查化学方程式计算,侧重考查学生分析计算能力,利用守恒法解答避免方程式繁琐,难度中等.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
5.氨气是一种重要的物质,在国民经济中占有重要地位.
(1)合成氨工业中,合成塔中每生成1mol NH3,放出46.1kJ热量.
①合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g),△H=-92.2KJ/mol.
②若在相同条件下投入amol N2和bmol H2,达平衡时,放出184.4kJ热量,则a>(填“>”、“<”或“=”)>2.
(2)下列有关合成氨的说法中正确的是D.
A.加入催化剂,是为降低反应的△H,提高反应速率
B.在较高温度下反应,是为提高反应物的平衡转化率
C.适当提高氮氢比,是为提高反应物的总能量,加快反应速率
D.选择高压,是为加快反应速率,并提高反应物平衡转化率
(3)合成氨原料中的H2可用甲烷与水蒸气在高温下反应制得.已知:Ⅰ.1mol物质完全燃烧生成常温下稳定氧化物的相关数据如下表:
Ⅱ.H2O(l)═H2O(g)△H=+44.0kJ/mol
Ⅲ.2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
①CH4燃烧生成气态产物的热化学方程式是CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ/mol.
②CH4和水蒸气在高温下反应得到CO和H2的热化学方程式是CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol.
(1)合成氨工业中,合成塔中每生成1mol NH3,放出46.1kJ热量.
①合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g),△H=-92.2KJ/mol.
②若在相同条件下投入amol N2和bmol H2,达平衡时,放出184.4kJ热量,则a>(填“>”、“<”或“=”)>2.
(2)下列有关合成氨的说法中正确的是D.
A.加入催化剂,是为降低反应的△H,提高反应速率
B.在较高温度下反应,是为提高反应物的平衡转化率
C.适当提高氮氢比,是为提高反应物的总能量,加快反应速率
D.选择高压,是为加快反应速率,并提高反应物平衡转化率
(3)合成氨原料中的H2可用甲烷与水蒸气在高温下反应制得.已知:Ⅰ.1mol物质完全燃烧生成常温下稳定氧化物的相关数据如下表:
| 物质 | △H(kJ/mol) |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
Ⅲ.2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
①CH4燃烧生成气态产物的热化学方程式是CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-802.3kJ/mol.
②CH4和水蒸气在高温下反应得到CO和H2的热化学方程式是CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.1kJ/mol.
6.下列说法中正确的是( )
| A. | 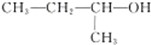 的名称为2-甲基-1-丙醇 的名称为2-甲基-1-丙醇 | |||||||||||||||||
| B. | 按照以下的排布规律,第15项物质可能与金属钠反应
| |||||||||||||||||
| C. | 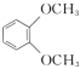 在核磁共振氢谱中出现两组峰,其氢原子个数之比为3:2 在核磁共振氢谱中出现两组峰,其氢原子个数之比为3:2 | |||||||||||||||||
| D. | 甲苯分子内所有原子均在同一平面 |
7.下列用品是用合成材料制成的是( )
| A. | 玻璃杯 | B. | 羊毛毯 | C. | 塑料啤酒箱 | D. | 铝合金窗 |
5.将C2H2、C2H4、C2H6三种气体分别放入不同容器中,使它们的温度、密度相同,则其压强p大小的关系,符号( )
| A. | p(C2H2)>p(C2H4)>p(C2H) | B. | p(C2H4)>p(C2H)>p(C2H2) | ||
| C. | p(C2H2)>p(C2H)>p(C2H4) | D. | p(C2H)>p(C2H4)>p(C2H2) |