题目内容
【题目】现用Pt电极电解1 L浓度均为0.1 mol·L-1的HCl、CuSO4的混合溶液,装置如图,下列说法正确的是( )
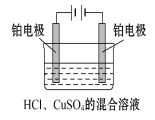
A.电解开始时阴极有H2放出
B.电解开始时阳极上发生:Cu2++2e-Cu
C.整个电解过程中,SO42-不参与电极反应
D.当电路中通过电子的量超过0.1 mol时,此时阴极放电的离子发生了变化
【答案】C
【解析】
A. 因为Cu2+得电子能力强于H+,所以电解开始时阴极有Cu析出,A错误;
B. 电解时阳极失电子,B错误;
C. SO42-失电子能力弱于OH-,在水溶液中没有机会失电子,所以整个电解过程中,SO42-不参与电极反应,C正确;
D. 当电路中通过电子的量超过0.2 mol时,Cu2+在阴极放电完成,此时阴极放电的离子为H+,D错误。
故选C。

【题目】氨气常用作合成氯氨类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(NH2C1、NHCl2和NCl3),副产物少于其它水消毒剂。
回答下列问题:
(1)工业上可利用反应Cl2(g)+NH3(g)=NH2Cl(l)+HCl(g)制备一氯胺,已知部分化学键的键能如下表所示(假设不同物质中同种化学键的键能相同),则该反应的△H=___kJ/mol。
化学键 | N-H | Cl-Cl | N-Cl | H-Cl |
键能(kJ/mol) | 391.3 | 243.0 | 191.2 | 431.8 |
一氯胺是重要的水消毒剂,其原因是由于一氯胺在中性、酸性环境中会发生完全水解,生成具有强烈杀菌消毒作用的物质,该水解反应的化学方程式为___。
(2)用Cl2和NH3反应制备二氯胺的方程式为2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。在恒温条件下,3molCl2和1molNH3发生反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
NHCl2(g)+2HCl(g)。在恒温条件下,3molCl2和1molNH3发生反应,测得平衡时Cl2和HCl的物质的量浓度与平衡总压的关系如图所示:
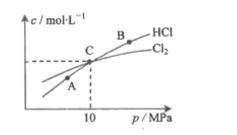
①A、B、C三点中Cl2转化率最高的是___点(填“A”“B”或“C")。
②计算C点时该反应的压强平衡常数Kp(C)=____(Kp是平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)我国研制出非贵金属镍钼基高效电催化剂,实现电解富尿素废水低能耗制H2(装置如图),总反应为:CO(NH2)2+H2O![]() 3H2↑+N2↑+CO2↑。
3H2↑+N2↑+CO2↑。
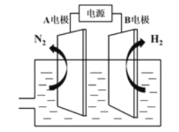
①A电极连接电源的___极(填"正”或“负”)。
②A电极的电极反应为___。