��Ŀ����
3��������Һ�ʼ��ԣ������ӷ���ʽ��ʾ��ԭ��S2-+H2O?HS-+OH-��HS-+H2O?H2S+OH-�����ھ��ÿ����е�������Һ���ɻ�ɫ������Ϊ�����˶����ƣ�Na2Sx�������ⶨ��100mL4mol•L-1�����Ƶ���Һǡ����100mL1.4mol•L-1���Ը��������Һ��Ӧ����������ͻ�ԭ����ֱ�ΪSO42-��Mn2+����1�������ƵĻ�ѧʽΪNa2S2��
��2��д��������Һ�ڿ��������ɶ����ƣ��þ��廯ѧʽ��ʾ���Ļ�ѧ����ʽ��4Na2S+O2+2H2O�T4NaOH+2Na2S2��
��3�������������ᷴӦ�����г�������ζ�������dz��ɫ���壬д����Ӧ�����ӷ���ʽ��S22-+2H+=H2S��+S����
���� ������ǿ�������Σ�������ˮ�����Һ�ʼ��ԣ�
��1�������ƣ�Na2Sx�������Ը��������Һ��Ӧ���������������Ϊ�����ƣ����������������ԭ��Mn2+����Ԫ�صĻ��ϼ۱仯����ת�Ƶĵ�������ȷ����������x���Ӷ�ȷ���仯ѧʽ��
��2��Na2S��Һ�ڿ����г��ڷ��ã���������Ӧ�������������ɶ����ƣ�SԪ�صĻ��ϼ���-2�۱�Ϊ-1�ۣ�
��3��Na2S2����Һ�����ᷴӦ�����Ȼ��ơ�S�����⣮
��� �⣺������ǿ�������Σ�������ˮ�����Һ�ʼ��ԣ�ˮ�ⷽ��ʽΪ��S2-+H2O?HS-+OH-��HS-+H2O?H2S+OH-��
�ʴ�Ϊ��S2-+H2O?HS-+OH-��HS-+H2O?H2S+OH-��
��1�����������Һ��Ӧ������ԭ��Mn2+��Mn��+7��+2����Na2Sx�������������Ϊ�����ƣ�S��-$\frac{2}{x}$��+6�����ɵ����غ��֪100mL��4mol•L-1��[+6-��-$\frac{2}{x}$��]��x=200mL��1.4mol•L-1��[+7-��+2��]����ã�x=5�����Ի�ѧʽΪ��Na2S2��
�ʴ�Ϊ��Na2S2��
��2��Na2S��������ˮ��Ӧ����Na2S2��NaOH���÷�Ӧ�ķ���ʽΪ4Na2S+O2+2H2O�T4NaOH+2Na2S2��
�ʴ�Ϊ��4Na2S+O2+2H2O�T4NaOH+2Na2S2��
��3�������������ᷴӦ�������г�������ζ������ΪH2S��dz��ɫ����ΪS�����ӷ���ʽΪ��S22-+2H+=H2S��+S����
�ʴ�Ϊ��S22-+2H+=H2S��+S����
���� ���⿼�����ӵ�ˮ�⡢������ԭ��Ӧ��Ϊ�߿���Ƶ���㣬���շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ���ע�⻯�ϼ���Ԫ�ص����ʼ�ϰ���е���Ϣ����Ŀ�Ѷ��еȣ�

| A�� | Na2CO3 | B�� | Na2SO4 | C�� | Al2O3 | D�� | Al |
| A�� | N2 | B�� | CO2 | C�� | H2 | D�� | O2 |
��֪����P4��g��+6Cl2��g���T4PCl3��g����H=a kJ•mol-1
P4��g��+10Cl2��g���T4PCl5��g����H=b kJ•mol-1
�ڼ��ֻ�ѧ���ļ����������£�����ָ����1mol��̬��ѧ��������̬ԭ�����յ�������
| ��ѧ�� | Cl-Cl | PCl3��P-Cl�� | PCl5��P-Cl�� |
| ����/kJ•mol-1 | d | 1.2c | c |
��1������1mol PCl5��g���л�ѧ�����������ȶ���1mol PCl3��g���л�ѧ������������0.2c��
��2��1mol P4�����к���6mol P-P����P-P���ļ���Ϊ��a-6d+4.8c��kJ•mol-1��
��3���ֿ��������ݣ��ܷ����Cl2��g��+PCl3��g���TPCl5��g���ķ�Ӧ�ȡ�H�������ܼ��㣬ȱʲô���ݣ�
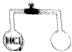 ��ͼ��ʾ����֪��ƿ�ݻ���ͬ��ͬ��ͬѹ�£���ƿ�ڳ����Ȼ������壬����ƿ�г������л�������е�ijһ��ʱ��������ԭ����������ƿ������ԭ������һ����ȣ���û�������ǣ�������
��ͼ��ʾ����֪��ƿ�ݻ���ͬ��ͬ��ͬѹ�£���ƿ�ڳ����Ȼ������壬����ƿ�г������л�������е�ijһ��ʱ��������ԭ����������ƿ������ԭ������һ����ȣ���û�������ǣ�������| A�� | O3��N2 | B�� | CH4��NH3 | C�� | N2��O2 | D�� | CO��CO2 |
| A�� | 1��2 | B�� | 2��l | C�� | 3��2 | D�� | 2��3 |
| A�� | 1��1��1 | B�� | 2��1��1 | C�� | 1��2��1 | D�� | 1��1��3 |
