题目内容
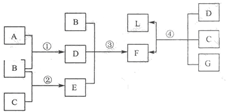 下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题:
下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题:
(1)写出B、L的名称:B______、L______;写出F在工业上的任何两点用途______.
(2)写出③的化学方程式______.
(3)说出形成单质C的元素在元素周期表的位置,第______周期,第______族.
(4)将E通入到某种棕黄色的溶液中也有L、F生成.其反应的离子方程式为______.
(5)写出④反应的化学方程式______.
解:框图中涉及的物质是中学化学常见,A、B、G通常为气态单质.说明是非金属单质,单质A在单质G中能燃烧,其产物溶于水得L;判断A为氢气,G为氯气,L为氯化氢;固体单质C可以在B中燃烧;说明B为氧气;BDE反应生产成本F,B是O2,D为水,和E反应,证明E一定是还原性的氧化物,说明固体C单质是硫,依据转化关系D为水,E为SO2;依据B+D+E→F可知,F为H2SO4;D+C+G→F+L,H2O+S+Cl2→H2SO4+HCl;综合上述可以推断:A、H2;B、O2;C、S;D、H2O;E、SO2;F、H2SO4;G、Cl2;L、HCl;
(1)依据上述分析判断,B为:氧气、L为盐酸,F是硫酸在工业上的任何两点用途为:制化肥、炸药、农药、染料、盐类、精炼石油、除锈、制挥发性酸等,故答案为:氧气 盐酸
制化肥、炸药、农药、染料、盐类、精炼石油、除锈、制挥发性酸等;
(2)③的化学方程式是B+D+E→F,化学方程式为:2SO2+2H2O+O2=2H2SO4;故答案为:2SO2+2H2O+O2=2H2SO4;
(3)形成单质C是硫,硫元素在元素周期表的位置第三周期 第ⅥA族,故答案为:第三周期 第ⅥA族;
(4)将SO2气体通入到某种棕黄色的溶液中也有HCl、H2SO4生成,说明棕黄色溶液是三价铁离子,反应的离子方程式为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
(5)反应④是D+C+G→F+L,H2O+S+Cl2→H2SO4+HCl;配平书写化学方程式为:3Cl2+S+4H2O=6HCl+H2SO4;故答案为:3Cl2+S+4H2O=6HCl+H2SO4.
分析:A、B、G通常为气态单质.说明是非金属单质,单质A在单质G中能燃烧,其产物溶于水得L;判断A为氢气,G为氯气,L为氯化氢;固体单质C可以在B中燃烧;说明B为氧气;BDE反应生产成本F,B是O2,D为水,和E反应,证明E一定是还原性的氧化物,说明固体C单质是硫,依据转化关系D为水,E为SO2;依据B+D+E→F可知,F为H2SO4;D+C+G→F+L,H2O+S+Cl2→H2SO4+HCl;综合上述可以推断:A、H2;B、O2;C、S;D、H2O;E、SO2;F、H2SO4;G、Cl2;L、HCl;依据判断出的物质进行分析判断和解答.
点评:本题考查了物质转化关系的应用,物质性质的综合运用,主要是分析清楚反应关系,结合物质是中学化学常见的物质进行推导判断,关键是氧化还原反应的判断应用.
(1)依据上述分析判断,B为:氧气、L为盐酸,F是硫酸在工业上的任何两点用途为:制化肥、炸药、农药、染料、盐类、精炼石油、除锈、制挥发性酸等,故答案为:氧气 盐酸
制化肥、炸药、农药、染料、盐类、精炼石油、除锈、制挥发性酸等;
(2)③的化学方程式是B+D+E→F,化学方程式为:2SO2+2H2O+O2=2H2SO4;故答案为:2SO2+2H2O+O2=2H2SO4;
(3)形成单质C是硫,硫元素在元素周期表的位置第三周期 第ⅥA族,故答案为:第三周期 第ⅥA族;
(4)将SO2气体通入到某种棕黄色的溶液中也有HCl、H2SO4生成,说明棕黄色溶液是三价铁离子,反应的离子方程式为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
故答案为:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;
(5)反应④是D+C+G→F+L,H2O+S+Cl2→H2SO4+HCl;配平书写化学方程式为:3Cl2+S+4H2O=6HCl+H2SO4;故答案为:3Cl2+S+4H2O=6HCl+H2SO4.
分析:A、B、G通常为气态单质.说明是非金属单质,单质A在单质G中能燃烧,其产物溶于水得L;判断A为氢气,G为氯气,L为氯化氢;固体单质C可以在B中燃烧;说明B为氧气;BDE反应生产成本F,B是O2,D为水,和E反应,证明E一定是还原性的氧化物,说明固体C单质是硫,依据转化关系D为水,E为SO2;依据B+D+E→F可知,F为H2SO4;D+C+G→F+L,H2O+S+Cl2→H2SO4+HCl;综合上述可以推断:A、H2;B、O2;C、S;D、H2O;E、SO2;F、H2SO4;G、Cl2;L、HCl;依据判断出的物质进行分析判断和解答.
点评:本题考查了物质转化关系的应用,物质性质的综合运用,主要是分析清楚反应关系,结合物质是中学化学常见的物质进行推导判断,关键是氧化还原反应的判断应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
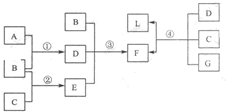 (2010?大连二模)下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题:
(2010?大连二模)下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题: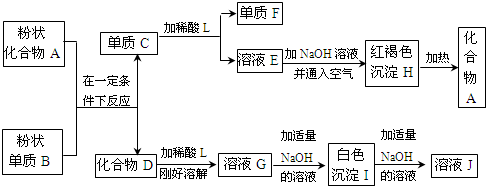
 L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
