题目内容
下列框图中涉及的物质都是中学化学中的常见物质.请根据框图中物质的变化,回答下列问题:
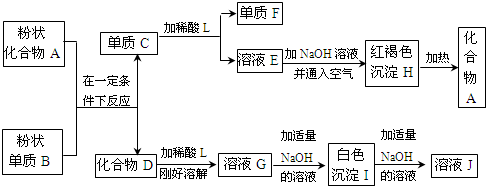
(1)写出下列物质的化学式:F是 ,J是 .
(2)稀酸L不可能是下列酸中的 .
A.H2SO4 B.HCl C.HNO3
(3)写出A+B→C+D的化学反应方程式(须注明反应条件): .
(4)如何用化学方法检验溶液E中的金属阳离子? .

(1)写出下列物质的化学式:F是
(2)稀酸L不可能是下列酸中的
A.H2SO4 B.HCl C.HNO3
(3)写出A+B→C+D的化学反应方程式(须注明反应条件):
(4)如何用化学方法检验溶液E中的金属阳离子?
分析:红褐色沉淀H为Fe(OH)3,加热分解得到化合物A为Fe2O3,与单质B反应生成C与D,由转化关系可知,该反应为铝热反应,故B为Al,C为Fe,D为Al2O3,Fe与稀酸反应生成单质F与E,则稀酸为非氧化性酸,为稀硫酸或盐酸,故F为H2,E为亚铁盐.氧化铝与稀酸反应生成G为铝盐,与NaOH反应生成白色沉淀I为Al(OH)3,氢氧化铝与氢氧化钠反应生成J为NaAlO2,据此解答.
解答:解:红褐色沉淀H为Fe(OH)3,加热分解得到化合物A为Fe2O3,与单质B反应生成C与D,由转化关系可知,该反应为铝热反应,故B为Al,C为Fe,D为Al2O3,Fe与稀酸反应生成单质F与E,则稀酸为非氧化性酸,为稀硫酸或盐酸,故F为H2,E为亚铁盐.氧化铝与稀酸反应生成G为铝盐,与NaOH反应生成白色沉淀I为Al(OH)3,氢氧化铝与氢氧化钠反应生成J为NaAlO2,
(1)由上述分析可知,F是H2,J是NaAlO2,故答案为:H2;NaAlO2;
(2)稀酸为非氧化性酸,为稀硫酸或盐酸,不能是硝酸,故答案为:C;
(3)A+B→C+D的化学反应方程式为:2Al+Fe2O3
2Fe+Al2O3,故答案为:2Al+Fe2O3
2Fe+Al2O3;
(4)E为亚铁盐,检验溶液E中的金属阳离子方法为:方案一:取E溶液少许于干净试管中,滴入KSCN溶液无血红色出现,再滴入新制氯水,溶液呈血红色,则可证明原溶液中含有Fe2+;
方案二:取E溶液少许于干净试管中,滴入几滴NaOH溶液,若观察到溶液中有白色沉淀产生,并逐渐转化灰绿色,最后变为红褐色,则可证明原溶液中含有Fe2+,
故答案为:方案一:取E溶液少许于干净试管中,滴入KSCN溶液无血红色出现,再滴入新制氯水,溶液呈血红色,则可证明原溶液中含有Fe2+;
方案二:取E溶液少许于干净试管中,滴入几滴NaOH溶液,若观察到溶液中有白色沉淀产生,并逐渐转化灰绿色,最后变为红褐色,则可证明原溶液中含有Fe2+.
(1)由上述分析可知,F是H2,J是NaAlO2,故答案为:H2;NaAlO2;
(2)稀酸为非氧化性酸,为稀硫酸或盐酸,不能是硝酸,故答案为:C;
(3)A+B→C+D的化学反应方程式为:2Al+Fe2O3
| ||
| ||
(4)E为亚铁盐,检验溶液E中的金属阳离子方法为:方案一:取E溶液少许于干净试管中,滴入KSCN溶液无血红色出现,再滴入新制氯水,溶液呈血红色,则可证明原溶液中含有Fe2+;
方案二:取E溶液少许于干净试管中,滴入几滴NaOH溶液,若观察到溶液中有白色沉淀产生,并逐渐转化灰绿色,最后变为红褐色,则可证明原溶液中含有Fe2+,
故答案为:方案一:取E溶液少许于干净试管中,滴入KSCN溶液无血红色出现,再滴入新制氯水,溶液呈血红色,则可证明原溶液中含有Fe2+;
方案二:取E溶液少许于干净试管中,滴入几滴NaOH溶液,若观察到溶液中有白色沉淀产生,并逐渐转化灰绿色,最后变为红褐色,则可证明原溶液中含有Fe2+.
点评:本题考查无机物推断,难度中等,H是红褐色沉淀为推断的突破口,结合转化关系确定A与B的反应为铝热反应是关键,注意基础知识的掌握.

练习册系列答案
相关题目
 (2010?大连二模)下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题:
(2010?大连二模)下列框图中涉及的物质是中学化学常见的.其相互转化关系如图所示.已知:单质A在单质G中能燃烧,其产物溶于水得L;固体单C可以在B中燃烧;A、B、G通常为气态单质.请回答有关问题: L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
L;固体单C可以在B中燃烧;A、B、G通常为气态单质。请回答有关问题:
