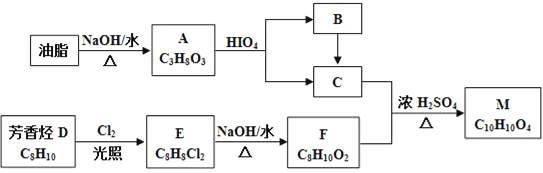
题目内容
【题目】已知亚磷酸(H3PO3)的结构如图,
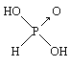
是具有强还原性的二元弱酸,可以被银离子氧化为磷酸。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式____。亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为____。
(2)某温度下,0.1mol/L的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2mol/L该温度下H3PO3的一级电离平衡常数![]() =____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:
=____。(H3PO3第二步电离忽略不计,结果保留两位有效数字)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:![]() ____
____![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
【答案】PCl3+3H2O=H3PO3+3H++3Cl 2:1 8.3×103mol·L-1 =
【解析】
因为1 mol亚磷酸最多消耗2 mol氢氧化钠,所以亚磷酸是二元弱酸;弱电解质电离常数为达到平衡时所生成的各种离子浓度的幂之积与溶液中未电离的分子浓度的比值;溶液中粒子浓度关系根据电荷守恒和物料守恒判断。
(1)PCl3中P是+3,可以结合OH-,生成H3PO3,Cl-结合H+生成HCl,所以反应的离子方程式为:PCl3+3H2O=H3PO3+3H++3Cl-,故答案为:PCl3+3H2O=H3PO3+3H++3Cl;
(2)结合题目信息可知,亚磷酸与银离子反应生成银单质和磷酸,用H+和H2O来配平电荷和原子,离子方程式为:H3PO3+2Ag++H2O= H3PO4+2Ag+2H+。氧化剂银离子和还原剂亚磷酸的物质的量之比为2:1,故答案为:2:1;
(3)根据电离方程式:
H3PO3 ![]() H+ + H2PO3-
H+ + H2PO3-
起始浓度: 0.1 0 0
转化浓度:2.5×10-2 2.5×10-2 2.5×10-2
平衡浓度:0.1-2.5×10-2 2.5×10-2 2.5×10-2
电离平衡常数:Ka1=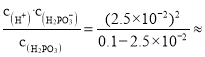 8.3×10-3mol·L-1,故答案为:8.3×10-3mol·L-1
8.3×10-3mol·L-1,故答案为:8.3×10-3mol·L-1
(4)根据电荷守恒:c(Na+)+ c(H+)=c(H2PO3-)+2c(HPO32-)+ c(OH-),溶液呈中性,c(H+)= c(OH-),因此c(Na+)= c(H2PO3-)+2c(HPO32-),故答案为:=。

 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案【题目】I.氮是地球上含量丰富的一种元素,氨、肼(N2H4)、尿素、偏二甲肼(C2H8N2)是氮的常见化合物,在科学技术和生产中有重要的应用。
(1)肼(N2H4)是一种高能燃料,写出肼的电子式________,有关化学反应的能量变化如下图所示,已知H2O(g)=H2O(l) ΔH=-44kJ·mol-1,写出肼燃烧的燃烧热的热化学方程式为__________。
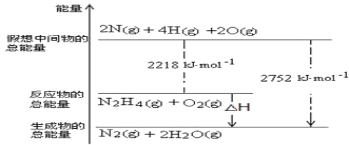
(2)火箭使用偏二甲肼(C2H8N2)作燃料,四氧化二氮(N2O4)为氧化剂,燃烧反应放出巨大能量把火箭送入太空,该反应的化学方程式为____________。
II.氨的合成是最重要的化工生产之一。
已知:N2(g)+3H2(g)2NH3(g) ΔH=-92.4 kJ·mol-1
在甲、乙、丙三个不同密闭容器中,按不同方式投料,起始温度和容积相同,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1molN2、3molH2 | 2molNH3 | 2molNH3 |
平衡时容器体积 | V甲 | V乙 | V丙 |
反应的平衡常数K | K甲 | K乙 | K丙 |
平衡时NH3的浓度/molL-1 | c甲 | c乙 | c丙 |
平衡时NH3的反应速率/molL-1min-1 | υ甲 | υ乙 | υ丙 |
则平衡时容器的体积V甲____________V丙,平衡常数K丙_________K乙(填>、<或=)
III.尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)合成尿素的第一步反应为:2NH3(g)+CO2(g)H2NCOONH4(氨基甲酸铵)(l) △H1 ,若加入恒温、恒容容器中的NH3和CO2的物质的量之比为2:1,能说明反应达到化学平衡状态的是________
a. CO2的浓度不再变化 b. NH3的百分含量不再变化 c. 容器内气体的密度不再变化 d. 混合气体的平均相对分子质量不再变化 e. 2υ(NH3)正=υ (CO2)逆
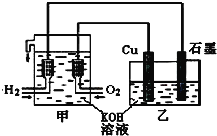
(2)尿素(NH2CONH2) 燃料电池结构如图所示。其工作时负极电极反应式可表示为:_________。