题目内容
【题目】向含H2S、Fe2+、Br-、I-各0.1 mol的溶液中通入Cl2 ,通入Cl2的体积(标准状况)和溶液中相关离子的物质的量关系图正确的是( )
A. 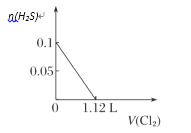 B.
B. 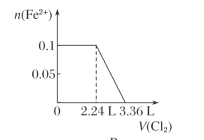
C. 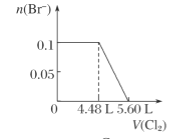 D.
D. 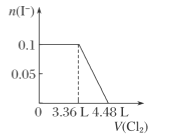
【答案】C
【解析】
微粒还原性H2S>I->Fe2+>Br-,故首先发生反应S2-+Cl2=S+2Cl-,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,据此判断。
微粒还原性H2S>I->Fe2+>Br-,故首先发生反应S2-+Cl2=S+2Cl-,再发生反应2I-+Cl2=I2+2Cl-,然后发生反应2Fe2++Cl2=2Fe3++2Cl-,最后发生反应2Br-+Cl2=Br2+2Cl-,根据发生反应顺序计算离子开始反应到该离子反应完毕时氯气的体积,0.1molH2S完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05氯气,0.1molFe2+完全反应消耗0.05氯气,0.1molBr-完全反应消耗0.05氯气。A.由H2S+Cl2=S↓+2H++2Cl-可知,0.1molH2S完全反应需要消耗0.1mol氯气,标准状况下的Cl2的体积为0.1mol×22.4L/mol=2.24L,图象中氯气的体积不符合,选项A错误;B.0.1molH2S完全反应需要消耗0.1mol氯气,0.1molI-完全反应消耗0.05氯气,故亚铁离子开始反应时氯气的体积为0.15mol×22.4L/mol=3.36L,由2Fe2++Cl2=2Fe3++2Cl-可知,0.1molFe2+完全反应消耗0.05氯气,故Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,图象与实际不符合,选项B错误;C.H2S、I-、Fe2+完全时消耗的氯气体积为0.2mol×22.4L/mol=4.48L,即溴离子开始反应时氯气的体积为4.48L,由2Br-+Cl2=2Br2+2Cl-可知,0.1molBr-完全反应消耗0.05氯气,故溴离子完全反应时消耗氯气的体积为4.48L+0.05mol×22.4L/mol=5.6L,图象中氯气的体积符合,选项C正确;D.0.1molH2S完全反应后,才发生2I-+Cl2=I2+2Cl-,0.1molH2S完全反应需要消耗0.1mol氯气,故开始反应时氯气的体积为2.24L,0.1molI-完全反应消耗0.05氯气,故0.1molI-完全反应时氯气的体积为0.15mol×22.4L/mol=3.36L,图象中氯气的体积不符合,选项D错误;答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案