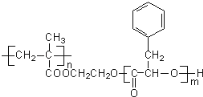
题目内容
【题目】已知亚硫酸钠隔绝空气加热到 600℃可以分解,实验流程如下图(所得气体是纯净物):
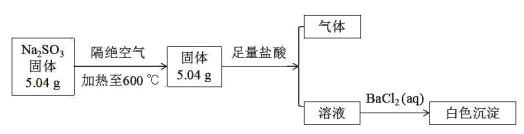
(1)硫元素在元素周期表中的位置_________________亚硫酸钠中含有的化学键类型 _________________ .
(2)写出亚硫酸钠受热分解的化学方程式 _________________ .
(3)下列说法正确的是 _________________ .
A.加热分解后的固体中氧元素质量为 1.92 克
B.生成白色沉淀的物质的量 0.04mol
C.分解后固体溶于水后,溶液中离子浓度大小顺序为c(Na+)> c(SO42-)>c(S2-)>c(OH-)>c(HS-)>c(H+)
D.将适量亚硫酸钠与分解后的固体混合,再加稀盐酸可能会出现沉淀
【答案】第三周期第ⅥA 族 离子键和共价键 4Na2SO3 Na2S + 3Na2SO4 ACD
【解析】
(1)硫是元素周期表中第16号元素,在元素周期表中的位置为第三周期第ⅥA 族,亚硫酸钠中钠离子和亚硫酸根离子间为离子键,亚硫酸根离子内为共价键。
(2)反应前后质量不变,说明生成物都是固体,根据加入盐酸可以生成气体,说明生成物有SO32-或S2-,加入BaCl2可以生成白色沉淀,说明生成物中有SO42-,所以生成物为硫化钠和硫酸钠。
(3)反应前后质量不变,说明生成物都是固体,加热分解后的固体中氧元素质量即初始Na2SO3中氧元素质量;生成白色沉淀的物质的量可利用物质的量算出,生成硫酸钠0.03mol,生成沉淀硫酸钡也为0.03mol;分解后得到硫化钠0.01mol、硫酸钠0.03mol,可以判断离子浓度;亚硫酸钠和硫化钠可以发生归中反应生成硫单质,可能会出现沉淀。
(1)硫在元素周期表中的位置为第三周期第ⅥA 族;亚硫酸钠是离子化合物,而亚硫酸根离子是共价键形成的,答案为:第三周期第ⅥA 族 ;离子键和共价键;
(2)因为反应前后质量不变,说明生成物全部是固体,根据题后信息可知受热分解是硫元素进行歧化反应,所以生成产物是硫化钠和硫酸钠,答案为:4Na2SO3 ![]() Na2S + 3Na2SO4;
Na2S + 3Na2SO4;
(3)A.由题给信息可知亚硫酸钠完全分解,而且产物中没有气体,所以氧元素质量即为 5.04 克亚硫酸钠中氧元素质量,即为 1.92 克,故正确; B.由反应方程式计算或由守恒方法判断生成沉淀的物质的量应为 0.03mol,故错误;C.根据生成的硫化钠和硫酸钠的数量关系以及硫化钠水解可判断该项正确;D.亚硫酸钠和硫化钠在酸性环境下可以发生归中反应生成硫单质,故正确。答案为:ACD。

【题目】某实验小组用工业上废渣(主要成分Cu2S和Fe2O3)制取纯铜和绿矾(FeSO4·7H2O)产品,设计流程如下:
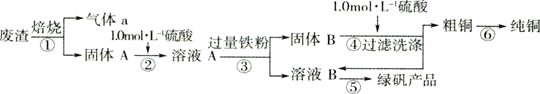
(1)在实验室中,欲用98%的浓硫酸(密度为1.84g·mL-1)配制500mL1.0mol·L-1的硫酸,需要取98%的浓硫酸______________mL(小数点后面保留一位有效数字);需要的仪器除量筒、烧杯、玻璃棒、胶头滴管,还有________。
(2)该小组同学设计如装置模拟废渣在过量氧气中焙烧,并验证废渣中含硫元素。
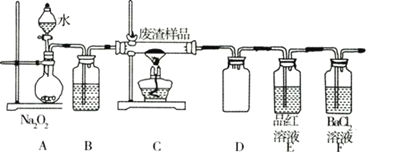
①置A中反应的化学方程式为_________;D装置起安全瓶作用____________ ,E装置中的现象是________
②反应装置不完善,为避免空气污染,要加装尾气处理装置所用试剂为________________溶液。
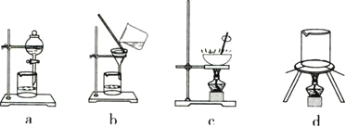
(3)从下列图中选择合适的装置,写出步骤⑤中进行的操作顺序 _______(填序号)
(4)为测定产品中绿矾的质量分数,称取30.0g样品溶于水配成250mL溶液,取25.00mL溶液于锥形瓶中,用0.1000mol·L-1酸性KMnO4溶液进行滴定,反应为:10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O.实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
KMnO4溶液体积/mL | 19.10 | 20.02 | 19.98 | 20.00 |
①第1组实验数据出现异常,造成这种异常的原因可能是________(填代号).
a.酸式滴管定管用蒸馏水洗净后未用标准液润洗
b.锥形瓶洗净后未干燥
c.滴定终点时俯视读数
d.滴定前尖嘴有气泡,滴定后气泡消失
②根据表中数据,计算所得产品中绿矾的质量分数为________。
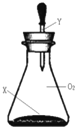
【题目】如图所示,常温时将一滴管液体Y一次性全部挤到充满O2的锥形瓶内(装置气密性良好),若锥形瓶内气体的最大物质的量是a mol,久置后其气体的物质的量是b mol,其中a≥b的是
X | Y |
| |
A | 少量C、Fe屑 | NaCl溶液 | |
B | 过量Na2SO3粉末 | 稀H2SO4 | |
C | 少量Fe块 | 浓H2SO4 | |
D | 过量Cu粉末 | 浓HNO3 |
A. A B. B C. C D. D