题目内容
【题目】红热的铁能与水蒸气反应,有氢气生成,现用如图所示装置进行铁在高温下与水蒸气反应的实验,并用简单的方法收集、检验生成的氢气。请回答下列问题:
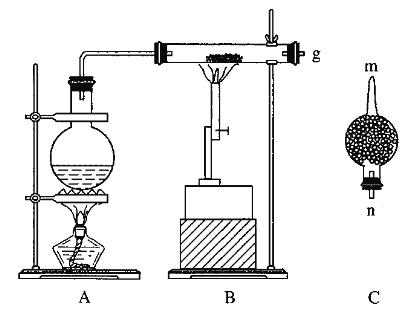
(1)写出铁在高温下与水蒸气反应的化学方程式:____________________________。
(2)干燥管C中盛放的是碱石灰,其作用是___________________。
(3)把B中反应后的产物加入足量的盐酸,用该溶液制取FeCl3·6H2O晶体。
①欲检验溶液中含有Fe3+,选用的试剂为____________,现象是______________________。
②该实验小组同学用上述试剂没有检测到Fe3+,用离子方程式解释滤液中不存在Fe3+可能的的原因:_________________。
③将此滤液中FeCl2完全氧化为FeCl3最好选择下列物质中的_______。
A.酸性KMnO4溶液 B.Cl2 C.Na2O2 D.FeCl3
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 吸收水蒸气(或干燥H2) KSCN溶液 溶液变红 2Fe3++Fe=3Fe2+ B
Fe3O4+4H2 吸收水蒸气(或干燥H2) KSCN溶液 溶液变红 2Fe3++Fe=3Fe2+ B
【解析】
本实验是利用红热的铁能与高温水蒸气反应,用简单的方法收集、检验生成的氢气。实验原理是3Fe+4H2O(g)![]() Fe3O4+4H2,该方法制取的氢气中含有大量的水蒸气,在收集氢气前必须干燥。反应后硬质玻璃管中的固体成分有两种可能:只有四氧化三铁或四氧化三铁与铁的混合物。加足量盐酸溶解固体时发生的反应有Fe3O4+8H+=2Fe3++Fe2++4H2O,2Fe3++Fe=3Fe2+。检验Fe3+的试剂是硫氰化钾溶液,为不引入新的杂质应选用Cl2将FeCl2氧化为FeCl3。由此分析。
Fe3O4+4H2,该方法制取的氢气中含有大量的水蒸气,在收集氢气前必须干燥。反应后硬质玻璃管中的固体成分有两种可能:只有四氧化三铁或四氧化三铁与铁的混合物。加足量盐酸溶解固体时发生的反应有Fe3O4+8H+=2Fe3++Fe2++4H2O,2Fe3++Fe=3Fe2+。检验Fe3+的试剂是硫氰化钾溶液,为不引入新的杂质应选用Cl2将FeCl2氧化为FeCl3。由此分析。
(1)高温条件下铁能将水蒸气中氢元素置换生成氢气和四氧化三铁,化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2。
Fe3O4+4H2。
(2)为防止收集的氢气中含有水蒸气,用装有碱石灰的干燥管吸收未反应的水蒸气,所以干燥管C的作用是吸收水蒸气(或干燥氢气)。
(3) B中反应后的固体物质可能是四氧化三铁或四氧化三铁和铁的混合物,加足量的盐酸可能发生的反应有Fe3O4+8H+=2Fe3++Fe2++4H2O,2Fe3++Fe=3Fe2+。①Fe3+的检验常用KSCN溶液,如果溶液变红证明含有Fe3+。②如果剩余的铁过量,Fe3+全部被铁还原为Fe2+时,加入的KSCN溶液就不会变红,溶液中就不存在Fe3+,其离子方程式是2Fe3++Fe=3Fe2+。③为了使最后得到的FeCl3·6H2O晶体尽量少含杂质,应该选用Cl2,2FeCl2+Cl2=2FeCl3,答案选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案