题目内容
9.铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片被腐蚀,当铜片上放出3.36 L(标准状况下)气体时,硫酸恰好恰好全部作用完,试回答:(1)写出正极、负极反应式;
(2)产生这些气体消耗了多少克锌?
(3)有多少个电子通过了导线?
(4)原稀硫酸的物质的量浓度是多少?
分析 (1)铜棒、锌片和200ml稀硫酸组成原电池,金属锌是负极,负极上发生氧化反应,铜是正极,正极上发生还原反应;
(2)根据气体与锌的关系式计算;
(3)根据氢气与电子的关系式计算;
(4)根据氢气与硫酸的关系计算硫酸的物质的量,再根据物质的量浓度公式计算其浓度.
解答 解:(1)铜棒、锌片和200ml稀硫酸组成原电池,金属锌是负极,铜是正极,原电池的两个电极发生的电极反应是:正极:2H++2e-=H2↑,负极:Zn-2e-=Zn2+,
答:正极反应为2H++2e-=H2↑;负极反应为Zn-2e-=Zn2+;
(2)设锌片的质量减少了x,
Zn+H2SO4=ZnSO4+H2↑
65g 22.4L
x 3.36L
所以 x=9.75g
答:锌片的质量减少了9.75g;
(3)设转移电子z,则
Zn+H2SO4=ZnSO4+H2↑ 转移电子
22.4L 2×6.02×1023个
3.36L z
所以z=1.806×1023个
答:1.806×1023个电子通过了导线;
(4)设硫酸的物质的量为y.
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
y 3.36L
所以y=0.15mol
C=$\frac{n}{V}$=0.75mol/L
答:原稀硫酸溶液的物质的量浓度0.75mol/L.
点评 本题以原电池为载体考查了氧化还原反应的有关计算,明确各物理量间的关系是解本题的关键.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
19.下列关于SO2的叙述,正确的是( )
| A. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 | |
| B. | SO2是硫酸的酸酐 | |
| C. | SO2可用于杀菌、消毒等,因此可以放心食用用大量SO2加工过的食物 | |
| D. | SO2具有漂白性,因而可以使石蕊试液褪色 |
20.下列各组元素的气态氢化物的稳定性由弱到强的一组是( )
| A. | F、Cl、Br | B. | N、O、F | C. | S、Cl、Br | D. | P、O、N |
14.将20gM物质、5gN物质、9gR物质混合加热发生化学反应,经充分反应后的混合物中含5gM物质、20gR物质还含有一种新物质Q.若M、N、R、Q的相对分子质量分别为30、20、44、18,它们之间发生反应的化学方程式是( )
| A. | M+N=Q+R | B. | M+2N=2R+Q | C. | 2M+N=2R+Q | D. | 2M+N=R+2Q |
6.一定量的气体在密闭容器中发生反应:xA(g)+yB(g)?zC(g),平衡时测得A的浓度为1.0mol•L-1,保持温度不变,将容器的容积扩大到原来的2倍,达到新平衡后,测得A的浓度降低为0.60mol•L-1.下列有关判断正确的是( )
| A. | 平衡向正反应方向移动 | B. | 物质B的转化率降低 | ||
| C. | x+y<z | D. | 物质C的体积分数增大 |
3.下列说法正确的是( )
| A. | 所有碳原子间只以单键相连的链烃是烷烃 | |
| B. | 所有糖类物质都有甜味 | |
| C. | 糖类、油脂、蛋白质都能水解 | |
| D. | 葡萄糖与蔗糖互为同分异构体 |
4.下列不属于可逆反应的是( )
| A. | Pb+PbO2+4H++2SO42-$?_{充电}^{放电}$2PbSO4+2H2O | |
| B. | 2SO2+O2$?_{△}^{催化剂}$2SO3 | |
| C. | Cl2+H2O?HCl+HClO | |
| D. | 2NO2?N2O4 |
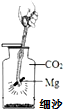 《消防知识手册》指出:活泼金属(如镁)燃烧引发的火灾不能用二氧化碳灭火.小明想:是不是活泼金属能与二氧化碳反应?他向老师要来镁带、一集气瓶的二氧化碳气体和必要的器材,在老师指导下按照如图所示进行实验.请回答下列问题.
《消防知识手册》指出:活泼金属(如镁)燃烧引发的火灾不能用二氧化碳灭火.小明想:是不是活泼金属能与二氧化碳反应?他向老师要来镁带、一集气瓶的二氧化碳气体和必要的器材,在老师指导下按照如图所示进行实验.请回答下列问题.