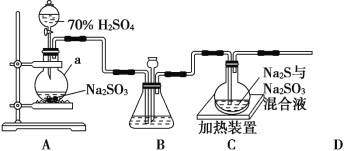
题目内容
【题目】如图所示。请回答:

(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Zn,A极材料为铜,该装置能量转换形式____, A为____极,此电池所发生的反应化学方程式为_____,反应进行一段时间后溶液C中c(H+)将_____(填“变大” “变小”或“基本不变”)。溶液中的SO42-移向____极(填“A”或“B”)
(2)若C为CuSO4溶液,B电极材料为Fe,A极材料为石墨。则B为_____极,B极上电极反应属于____(填“氧化反应”或“还原反应”)。B电极上发生的电极反应式为______,A极产生的现象是_____;若AB两电极质量都为50.0g且反应过程中有0.2mol的电子发生转移,理论上AB两电极质量差为____g。
【答案】化学能转化为电能 正 H2SO4+ Zn==H2↑+ZnSO4 减小 B 负 氧化反应 Fe-2e-==Fe2+ 有红色物质析出 12.0
【解析】
(1)锌比铜活泼,则锌作负极,原电池反应是锌与稀硫酸置换氢气的反应,正极反应是氢离子得电子生成氢气,负极上是金属铁发生失去电子的氧化反应,结合原电池的工作原理分析作答;
(2)若C为CuSO4溶液,B电极材料为Fe,A极材料为石墨,则总反应为铁与硫酸铜发生自发的氧化还原反应。原电池中,B电极为负极,发生失电子的氧化反应,A电极为正极,发生得电子的还原反应,结合原电池的工作原理及电化学计算中电子转移数守恒作答;
(1)锌比铜活泼,则该装置为锌作负极,铜做正极的原电池,化学能转化为电能;A极材料为铜,即A为正极,则该原电池反应是锌与稀硫酸置换氢气的反应, H2SO4+ Zn==H2↑+ZnSO4;依据总反应可知溶液中氢离子放电,导致溶液中氢离子浓度减小;原电池中阴离子移向负极,则溶液中的SO42-移向B极,
故答案为:正;H2SO4+ Zn==H2↑+ZnSO4;减小;B;
(2)依据上述分析易知:B电极为原电池的负极,发生发生失电子的氧化反应,其电极反应式为:Fe-2e-==Fe2+;A极铜离子得电子转化为铜单质,其电极反应式为:Cu2++2e-=Cu,故现象为:有红色物质析出;反应过程中有0.2mol的电子发生转移,则消耗的铁的质量为m(Fe)= ![]() =5.6g,生成的铜的质量为m(Cu)=
=5.6g,生成的铜的质量为m(Cu)= ![]() =6.4g,则两极的质量差为m(Fe)+ m(Cu)=5.6g+6.4g=12.0g,故答案为:负;氧化反应;Fe-2e-==Fe2+;有红色物质析出;12.0;
=6.4g,则两极的质量差为m(Fe)+ m(Cu)=5.6g+6.4g=12.0g,故答案为:负;氧化反应;Fe-2e-==Fe2+;有红色物质析出;12.0;

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】X、Y、Z、W代表四种短周期元素,有关它们的部分结构信息及性质信息如表所示。
元素 | 部分结构信息 | 部分性质信息 |
X | X的单质由双原子分子构成 | X的氢化物水溶液呈碱性 |
Y | Y原子的最外层电子数是其内层电子数的两倍 | Y能形成多种气态氢化物 |
Z | Z原子有三个电子层 | 含有Z元素的化合物的焰色反应呈黄色 |
W | W原子的最外层电子数等于(2n+1)(n为原子核外电子层数) | W和Z能按1∶1的原子个数比形成离子化合物 |
请按要求回答下列问题:
(1)W在元素周期表中的位置是______。
(2)X简单气态氢化物的分子式为______。(用化学式表示)
(3)X、Y、W三种元素的最高价氧化物对应水化物的酸性由强到弱的顺序是______。(用化学式表示)
(4)Z单质在W单质中发生反应的实验现象是______。
(5)写出W的单质与二氧化硫的混合气体通入水中所发生反应的离子方程式:______。