题目内容
【题目】工业上常利用含硫废水生产 Na2S2O3·5H2O,实验室可用如图装置(略去部分夹持仪器)模拟生产过程
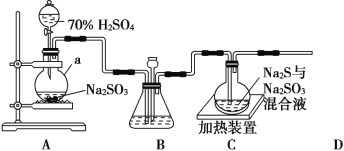
(1)仪器a的名称是__________,A中发生的化学反应方程为_______________________;
(2)实验中,为使 SO2 缓慢进入装置C,采用的操作______________,装置C中制备反应结束的现象___________________;
(3)装置 C 中的溶液一般需控制在碱性环境,否则产品发黄,用离子方程式表示其原因为 ___________________;
(4)为减少装置C中可能出现的Na2SO4杂质,在不改变原有装置的基础上应采取的操作是__________________;
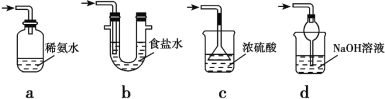
(5)装置 D 用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_____(填序号)。
【答案】圆底烧瓶 H2SO4+Na2SO3=Na2SO4+SO2↑+H2O 控制滴加硫酸的速度 溶液重新变澄清 S2O32-+2H+=S↓+SO2↑+H2O 先通一段时间的SO2,再加热装置C d
【解析】
(1)仪器a为圆底烧瓶,A中发生的反应为浓硫酸和亚硫酸钠反应生成二氧化硫气体的反应;
(2)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液重新变澄清;
(3)酸性溶液中硫代硫酸根离子会反应生成单质硫;
(4)先通一会二氧化硫气体把空气排净,再打开加热装置,避免了亚硫酸钠被氧化为硫酸钠;
(5)根据二氧化硫的性质选用合理的尾气装置。
(1)仪器a为圆底烧瓶,A中发生的反应为浓硫酸和亚硫酸钠反应生成二氧化硫气体的反应,化学方程式为:H2SO4+Na2SO3=Na2SO4+SO2↑+H2O,故答案为:圆底烧瓶;Na2SO3+H2SO4═Na2SO4+SO2↑+H2O。
(2)分液漏斗有玻璃活塞,通过控制分液漏斗的活塞控制滴加硫酸的速度,可以控制产生二氧化硫的速率,所以为使SO2缓慢进入烧瓶C,采用的操作是控制滴加硫酸的速度,根据C中发生的反应可知,烧瓶C中反应达到终点发生反应为硫与亚硫酸钠反应生成硫代硫酸钠,反应的现象为溶液重新变澄清,故答案为:控制滴加硫酸的速度;溶液重新变澄清。
(3)酸性溶液中硫代硫酸根离子会反应生成单质硫,产品发黄,反应的离子方程式为:S2O32-+2H+═S↓+SO2↑+H2O,故答案为:S2O32-+2H+═S↓+SO2↑+H2O。
(4)为减少装置C中常可能出现的Na2SO4杂质,在不改变原有装置的基础上先通一会二氧化硫气体把空气排净,再打开加热装置,避免了亚硫酸钠被氧化为硫酸钠,故答案为:先通一段时间SO2,再打开加热装置C。
(5)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故a错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故b错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故c错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故d正确。
故答案为:d。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案