题目内容
【题目】下列有关实验仪器的使用及实验操作正确的是
A.蒸发皿和烧杯均可用于加热
B.为减少仪器使用而带来的误差,中和热测定实验中可用温度计兼做搅拌棒
C.配置1L0.1mol·L-1NaCl溶液的实验中,用托盘天平称取5.85gNaCl
D.测定溶液中草酸含量时,用碱式滴定管盛装KMnO4标准液进行滴定操作
【答案】A
【解析】
A、蒸发皿可以直接加热,烧杯垫上石棉网也可用于加热,A正确;
B、温度计不能当做搅拌棒使用,B错误;
C、托盘天平只能精确到0.1g,C错误;
D、KMnO4具有强氧化性,会腐蚀橡胶管,不能用碱式滴定管盛装,D错误;
答案选A。

【题目】研究CO、NO、NO2等气体的性质,以便消除污染或变废为宝,可以保护环境、节约资源.试运用所学知识,解决下列问题:
(1)生产水煤气过程中有以下反应: ①C(s)+CO2(g)2CO(g)△H1;
②CO(g)+H2O(g)H2(g)+CO2(g)△H2;
③C(s)+H2O(g)CO(g)+H2(g)△H3;
若平衡表达式为K= ![]() ,则它所对应的化学反应方程式是(填序号) .
,则它所对应的化学反应方程式是(填序号) .
(2)对反应①下列说法中能说明该反应达到平衡状态的 a.温度和体积一定时,混合气体的颜色不再变化
b.温度和体积一定时,容器内的压强不再变化
c.温度和体积一定时,生成物的浓度不再变化
d.温度和体积一定时,混合气体的密度不再变化
(3)不同温度下反应②的平衡常数如下表所示.则△H20(填“<”或“>”);在500℃时,把等物质的量浓度的CO和H2O(g)充入反应容器,达到平衡时c(CO)=0.005molL﹣1、c(H2)=0.015molL﹣1 , 则CO的平衡转化率为 .
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.945795506 | 9 | 1 |
(4)对反应2NO2(g)N2O4(g)△H<0在温度为T1、T2时,平衡体系N2O4的体积分数随压强变化曲线如图所示. 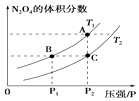
则T1T2(填“>”或“<”);增大压强,平衡移动(填“正反应方向”或“逆反应方向”或“不”);B、C两点的平衡常数BC(填“>”或“<”).