题目内容
现有部分短周期元素的性质或原子结构如下表:
(1)根据元素X的一种同位素的含量可测定文物年代,这种同位素的符号是
(2)元素Y氢化物的电子式是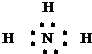
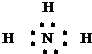 ;分子空间构型是
;分子空间构型是
(3)元素Y、Z与氢元素形成的化合物是一种化肥,该物质中存在的化学键类型(选填序号字母)有
a.离子键 b.极性共价键 c.非极性共价键
(4)元素W与元素Z相比,非金属性较强的是
| 元素编号 | 元素性质或原子结构 |
| W | 元素最高正价与最低负价代数和为2 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
14C
14C
.(2)元素Y氢化物的电子式是
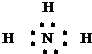
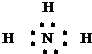
三角锥
三角锥
.(3)元素Y、Z与氢元素形成的化合物是一种化肥,该物质中存在的化学键类型(选填序号字母)有
ab
ab
.a.离子键 b.极性共价键 c.非极性共价键
(4)元素W与元素Z相比,非金属性较强的是
Cl
Cl
(用元素符号表示),能证明的事实是高氯酸酸性比磷酸酸性强
高氯酸酸性比磷酸酸性强
.分析:短周期元素,X元素原子最外层电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y单质为双原子分子,其氢化物水溶液呈碱性,则Y为氮元素;W元素最高正价与最低负价代数和为2,处于ⅤA族,故W为磷元素;Z元素最高正价是+7价,则Z为Cl元素,据此解答.
解答:解:短周期元素,X元素原子最外层电子数是次外层电子数的2倍,则X原子有2个电子层,最外层电子数为4,则X为碳元素;Y单质为双原子分子,其氢化物水溶液呈碱性,则Y为氮元素;W元素最高正价与最低负价代数和为2,处于ⅤA族,故W为磷元素;Z元素最高正价是+7价,则Z为Cl元素,
(1)根据元素X的一种同位素的含量可测定文物年代,这种同位素的符号是14C,
故答案为:14C;
(2)元素Y氢化物为NH3,分子中氮原子与氢原子之间形成1对共用电子对,故其电子式为,N原子价层电子对数=4,含有1对孤电子对,为三角锥型,
故答案为: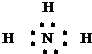 ;三角锥;
;三角锥;
(3)元素Y、Z与氢元素形成的化合物是一种化肥为氯化铵,由氯离子与铵根离子构成,含有离子键,铵根离子中氮原子与氢原子之间形成极性共价键,
故答案为:ab;
(4)同周期自左而右元素非金属性增强,故非金属性Cl>P,高氯酸酸性比磷酸酸性强可以说明Cl元素的非金属性强,
故答案为:Cl;高氯酸酸性比磷酸酸性强.
(1)根据元素X的一种同位素的含量可测定文物年代,这种同位素的符号是14C,
故答案为:14C;
(2)元素Y氢化物为NH3,分子中氮原子与氢原子之间形成1对共用电子对,故其电子式为,N原子价层电子对数=4,含有1对孤电子对,为三角锥型,
故答案为:
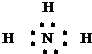 ;三角锥;
;三角锥;(3)元素Y、Z与氢元素形成的化合物是一种化肥为氯化铵,由氯离子与铵根离子构成,含有离子键,铵根离子中氮原子与氢原子之间形成极性共价键,
故答案为:ab;
(4)同周期自左而右元素非金属性增强,故非金属性Cl>P,高氯酸酸性比磷酸酸性强可以说明Cl元素的非金属性强,
故答案为:Cl;高氯酸酸性比磷酸酸性强.
点评:本题考查结构性质位置关系、常用化学用语、化学键、元素周期律等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
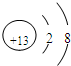
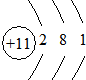
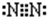
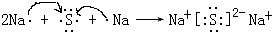
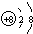
 Al(OH)3
Al(OH)3 Al3++3OH-
Al3++3OH-