题目内容
用惰性电极电解400 mL一定浓度的硫酸铜溶液(不考虑电解过程中溶液体积的变化),通电一段时间后,如果向所得的溶液中加入0.05 mol Cu2(OH)2CO3后,使溶液恰好恢复到电解前的浓度和体积(不考虑CO2的溶解),电解过程中转移的电子物质的量为( )
| A.0.2 mol | B.0.3mol |
| C.0.4 mol | D.0.6 mol |
B
解析试题分析:电解硫酸铜溶液后溶液呈酸性,向电解后的溶液中加入碱式碳酸铜能恢复成原溶液,碱式碳酸铜和硫酸反应生成硫酸铜、水和二氧化碳(不考虑CO2的溶解),溶液质量增加的量是铜、氢氧根离子,所以实际上电解硫酸铜溶液分两个阶段:第一阶段2CuSO4+2H2O  2Cu↓+O2↑+2H2SO4,第二阶段:2H2O
2Cu↓+O2↑+2H2SO4,第二阶段:2H2O 2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuO?H2O?CO2,所以加入0.05molCu2(OH)2CO3 就相当于加入0.1molCuO和0.05mol水,第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.1mol,转移电子的物质的量=0.1mol×2=0.2mol;第二阶段:电解生成0.05mol水转移电子的物质的量=0.05mol×2=0.1mol,所以解过程中共转移的电子数为0.2mol+0.1mol=0.3mol,答案选B。
2H2↑+O2↑,将碱式碳酸铜化学式改变为2CuO?H2O?CO2,所以加入0.05molCu2(OH)2CO3 就相当于加入0.1molCuO和0.05mol水,第一阶段:根据铜原子守恒知,电解硫酸铜溶液析出n(Cu)=n(CuO)=0.1mol,转移电子的物质的量=0.1mol×2=0.2mol;第二阶段:电解生成0.05mol水转移电子的物质的量=0.05mol×2=0.1mol,所以解过程中共转移的电子数为0.2mol+0.1mol=0.3mol,答案选B。
考点:考查电解原理,氧化还原反应的电子转移数目计算

下列有关原电池的说法中,正确的是( )
| A.铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极 |
| B.铝片和铜片用导线连接后插入浓硝酸中,铜作负极 |
| C.镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| D.将反应2Fe3++Fe=3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质 |
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH4O + 3O2 = 2CO2↑+ 4H2O,下图是该燃料电池的示意图。下列说法错误的是( )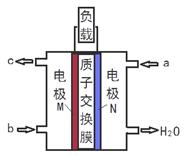
| A.燃料电池将化学能转化为电能 |
| B.a是甲醇、b是氧气 |
| C.质子从M电极区穿过交换膜移向N电极区 |
| D.负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+ |
汽车的启动电源常用铅蓄电池。其结构如下图所示,放电时的电池反应如下:PbO2+Pb+2H2SO4=2PbSO4+2H2O根据此反应判断下列叙述中正确的是
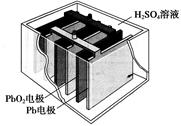
| A.PbO2是电池的负极 |
| B.放电时,溶液中的H+向正极区移动,正极区域的溶液的酸性增强 |
| C.放电时,电子由Pb电极通过导线流向PbO2 |
| D.正极的电极反应式为Pb-2e-=Pb2+ |
下图各容器中盛有海水,铁在其中被腐蚀时由快到满的顺序是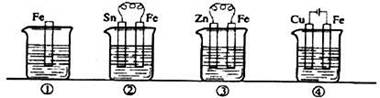
| A.③>②>④>① | B.②>①>③>④ |
| C.④>②>③>① | D.④>②>①>③ |
化学家正在研究尿素动力燃料电池,尿液也能发电。用这种电池直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,下列关于描述正确的是
| A.电池工作时H+ 移向负极 |
| B.该电池用的电解质溶液是KOH溶液 |
| C.甲电极反应式为:CO(NH2 )2 +H2O - 6e-= CO2 +N 2 + 6H+ |
| D.电池工作时,理论每有净化1mol CO(NH2 )2,消耗 33.6 L O2 |
500 mL NaNO3和Cu(NO3)2的混合溶液中c(NO3- )=0.3 mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12 L(标准状况下),假定电解后溶液体积仍为500 mL,下列说法正确的是
| A.原混合溶液中c(Na+)=0.2 mol·L-1 |
| B.电解后溶液中c(H+)=0.2 mol·L-1 |
| C.上述电解过程中共转移0.4 mol电子 |
| D.电解后得到的Cu的物质的量为0.1 mol |
下列有关说法正确的是
A.氨水稀释后,溶液中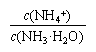 的值减小 的值减小 |
| B.0.1 mol·L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 |
| C.电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
| D.298 K时,2H2S(g)+SO2(g)=3S(s)+2H2O(l)能自发进行,则其ΔH>0 |
