题目内容
某一反应体系中存在以下五种物质:Na3AsO3、H2O、I2、Na3AsO4、HI(1)若水是产物,试用这五种物质组成一个合理的反应方程式,配平并标出电子转移的方向和数目:______;
(2)当pH为5~9时,该反应体系中的氧化反应为由HI→I2;当pH<4时,反应向逆反应方向进行,此时体系中的氧化反应为由______→______.如果两种情况下反应中转移电子数相等,则两个反应中氧化剂的物质的量之比是______;
(3)物质的氧化性和还原性不仅与溶液的酸碱性有关,还与物质的浓度和反应温度等因素有关.下列各组物质由于浓度不同而发生不同氧化还原反应的是(填序号)______.
①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Fe与HCl溶液 ④Zn与H2SO4溶液.
【答案】分析:(1)元素处于最高价时只有氧化性,处于最低价时只有还原性;
(2)当pH<4时,反应向逆反应方向进行,即反应从I2→HI,碘元素发生了氧化反应,则另一个半反应应该是发生了还原反应,并且得失电子的数目是相等的;
(3)①铜和浓硝酸反应产生NO2,和稀硝酸反应产生NO;
②铜和三价铁反应只有一种结果生成亚铁离子和铜离子;
③盐酸是非氧化性的酸,和铁反应生成亚铁盐和氢气;
④稀硫酸和金属锌反应产生氢气,和浓硫酸反应生成二氧化硫;
解答:解:(1)当元素处于最高价时只有氧化性,所以Na3AsO4在反应中做氧化剂,对应的产物为Na3AsO3,当元素处于最低价时只有还原性,所以HI在反应中做还原剂,对应的产物为I2,故答案为: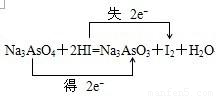 ;
;
(2)当pH<4时,反应从I2→HI,碘元素发生了还原反应,转移电子数目为2mol,则另一个半反应应该是发生了还原反应,即为Na3AsO3→Na3AsO4,转移电子数目为2mol,所以两情况下反应中氧化剂的物质的量之比是1:1,故答案为:Na3AsO3; Na3AsO4;1:1;
(3)①硝酸是氧化性的酸,铜和浓硝酸反应产生NO2,和稀硝酸反应产生NO,产物和硝酸浓度有关,故①正确;
②铜和三价铁反应只有一种结果生成亚铁和铜离子,和浓度无关,故②错误;
③盐酸是非氧化性的酸,和铁反应生成亚铁盐和氢气,和盐酸浓度无关,故③错误;
④稀硫酸和金属锌反应产生氢气,和浓硫酸反应生成二氧化硫,产物和硫酸浓度有关,故④正确.
故答案为:①④.
点评:本题是一道有关氧化还原知识的题目,考查了学生方程式中的电子转移知识,综合性较强,难度较大.
(2)当pH<4时,反应向逆反应方向进行,即反应从I2→HI,碘元素发生了氧化反应,则另一个半反应应该是发生了还原反应,并且得失电子的数目是相等的;
(3)①铜和浓硝酸反应产生NO2,和稀硝酸反应产生NO;
②铜和三价铁反应只有一种结果生成亚铁离子和铜离子;
③盐酸是非氧化性的酸,和铁反应生成亚铁盐和氢气;
④稀硫酸和金属锌反应产生氢气,和浓硫酸反应生成二氧化硫;
解答:解:(1)当元素处于最高价时只有氧化性,所以Na3AsO4在反应中做氧化剂,对应的产物为Na3AsO3,当元素处于最低价时只有还原性,所以HI在反应中做还原剂,对应的产物为I2,故答案为:
 ;
;(2)当pH<4时,反应从I2→HI,碘元素发生了还原反应,转移电子数目为2mol,则另一个半反应应该是发生了还原反应,即为Na3AsO3→Na3AsO4,转移电子数目为2mol,所以两情况下反应中氧化剂的物质的量之比是1:1,故答案为:Na3AsO3; Na3AsO4;1:1;
(3)①硝酸是氧化性的酸,铜和浓硝酸反应产生NO2,和稀硝酸反应产生NO,产物和硝酸浓度有关,故①正确;
②铜和三价铁反应只有一种结果生成亚铁和铜离子,和浓度无关,故②错误;
③盐酸是非氧化性的酸,和铁反应生成亚铁盐和氢气,和盐酸浓度无关,故③错误;
④稀硫酸和金属锌反应产生氢气,和浓硫酸反应生成二氧化硫,产物和硫酸浓度有关,故④正确.
故答案为:①④.
点评:本题是一道有关氧化还原知识的题目,考查了学生方程式中的电子转移知识,综合性较强,难度较大.

练习册系列答案
相关题目
 化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
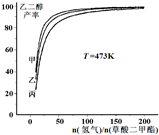 (氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
(氢气)/n(草酸二甲酯)]和压强的变化关系,其中三条曲线分别表示体系压强为1.5MPa、2.5MPa、3.5MPa的情况,则曲线甲对应的压强是P(甲)=
 HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
HOCH2-CH2OH(g)+2CH3OH(g)
△H = -34 kJ/mol
 H++OH-、HC2O4-
H++OH-、HC2O4- CH3OH(g)+H2O(g) △H
= —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H
= —49.0kJ/mo1.
 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液 mL混合反应而得,则下列说法中正确的是 __。
mL混合反应而得,则下列说法中正确的是 __。