题目内容
【题目】某兴趣小组探究SO2气体还原Fe3+,他们使用的药品和装置如下图所示,下列说法不合理的是
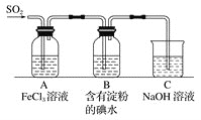
A. 能表明I-的还原性弱于SO2的现象是B中蓝色溶液褪色
B. 装置C的作用是吸收SO2尾气,防止污染空气
C. 为了验证A中发生了氧化还原反应,加入KMnO4溶液,紫红色褪去
D. 为了验证A中发生了氧化还原反应,加入用稀盐酸酸化的BaCl2溶液,产生白色沉淀
【答案】C
【解析】
A、B中蓝色褪去,说明二氧化硫和碘单质反应,I2+SO2+2H2O=2HI+H2SO4,依据氧化还原反应中还原剂的还原性大于还原产物,二氧化硫还原性大于碘离子,故A正确;
B、二氧化硫是污染性气体不能排放到空气中,需要用氢氧化钠溶液吸收,因此装置C的作用是吸收SO2尾气,防止污染空气,故B正确;
C、二氧化硫、亚铁离子都具有还原性,都可以和高锰酸钾溶液发生反应使之褪色,不能验证A中发生了氧化还原反应,故C错误;
D、铁离子氧化二氧化硫为硫酸,2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,加入氯化钡生成白色沉淀说明反应进行生成了硫酸根离子,故D正确;
故答案选C。

练习册系列答案
相关题目