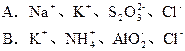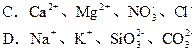题目内容
某碱性溶液中只有Na+、CH3COO-、H+、OH-四种离子。则下列描述正确的是( )
| A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈蓝色 |
| B.该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 |
| C.在NaOH溶液中加入一定量的CH3COOH溶液,只有当溶液中离子浓度满足: c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,才符合题意。 |
| D.加入适量氨水,c(CH3COO-)一定大于c(Na+)、c(NH4+)之和 |
B
首先要强调隐含条件“碱性”,得出:c(OH-)>c(H+),再根据电荷守恒推出(Na+)>c(CH3COO-)。
A项恰好满足n(OH-)=n(H+),即酸和碱已电离出来的、H+、OH-恰好完全中和,但是由于醋酸是弱酸,大量的未电离,即大量剩余,故混合后溶液呈酸性。
B项是等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合,则恰好中和转化成为CH3COONa溶液,属于强碱弱酸盐溶液,故呈碱性,合乎题意。
C项中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,是满足题意的唯一条件吗?这是本题的难点,实际上c(Na+)>c(OH-)>c(CH3COO-)>c(H+)也可以,相当于加入的醋酸很少。
D项是在原溶液中加入适量氨水,溶液仍呈碱性,根据c(OH-)>c(H+)、(Na+)>c(CH3COO-),得出c(CH3COO-)一定大于c(Na+)、c(NH4+)之和的说法是错误的。
A项恰好满足n(OH-)=n(H+),即酸和碱已电离出来的、H+、OH-恰好完全中和,但是由于醋酸是弱酸,大量的未电离,即大量剩余,故混合后溶液呈酸性。
B项是等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合,则恰好中和转化成为CH3COONa溶液,属于强碱弱酸盐溶液,故呈碱性,合乎题意。
C项中c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,是满足题意的唯一条件吗?这是本题的难点,实际上c(Na+)>c(OH-)>c(CH3COO-)>c(H+)也可以,相当于加入的醋酸很少。
D项是在原溶液中加入适量氨水,溶液仍呈碱性,根据c(OH-)>c(H+)、(Na+)>c(CH3COO-),得出c(CH3COO-)一定大于c(Na+)、c(NH4+)之和的说法是错误的。

练习册系列答案
相关题目