题目内容
14.将6.50g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应.求:(1)6.50g锌的物质的量;
(2)所用盐酸中HCl的物质的量浓度;
(3)反应中生成的在标准状况下H2的体积.
分析 (1)根据n=$\frac{m}{M}$计算Zn的物质的量;
(2)发生反应:Zn+2HCl═ZnCl2+H2↑,根据方程式计算HCl物质的量,再根据c=$\frac{n}{V}$计算;
(3)根据方程式计算生成氢气物质的量,再根据V=nVm计算氢气体积.
解答 解:(1)6.50g锌的物质的量:n(Zn)=$\frac{6.5g}{{65g/mo{l^{-1}}}}$=0.100mol,
答:6.50g锌的物质的量为0.100mol,
(2)设HCl物质的量为x,则:
Zn+2HCl═ZnCl2+H2↑
1mol 2mol
0.1mol x
所以x=$\frac{0.1mol×2mol}{1mol}$=0.2mol,故c(HCl)=$\frac{0.2mol}{0.2L}$=1mol/L,
答:所用盐酸中HCl的物质的量浓度为1mol/L;
(3)由Zn+2HCl═ZnCl2+H2↑,可知n(H2)=n(Zn)=0.1mol,则V(H2)=0.1mol×22.4L/mol=2.24L,
答:标况下生成氢气体积为2.24L.
点评 本题考查化学方程式有关计算,比较基础,旨在考查学生对基础知识的掌握.

练习册系列答案
 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
相关题目
4.下列叙述正确的是( )
| A. | 蔗糖与浓硫酸反应中有海绵状的炭生成,是因为浓硫酸具有吸水性能使蔗糖炭化 | |
| B. | 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体,体现浓硫酸的强氧化性 | |
| C. | 浓硫酸是一种干燥剂,能够干燥硫化氢、氢气等气体 | |
| D. | 浓硫酸在常温下可用铁桶盛装,是因为常温下浓硫酸能够使铁、铝等金属钝化 |
2.下列实验操作中有错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,温度计水银球应浸没在液体中 | |
| C. | 蒸馏中,冷却水应从冷凝管的下口通入,上口流出 | |
| D. | 把几滴FeCl3饱和溶液滴入250mL沸水中继续煮沸至红褐色制取Fe(OH)3胶体 |
6.下列物质组合中,既能和强酸反应又能和强碱反应的物质是( )
①Al ②Al2O3 ③Al(OH)3 ④AlCl3⑤NaHCO3.
①Al ②Al2O3 ③Al(OH)3 ④AlCl3⑤NaHCO3.
| A. | ①②③⑤ | B. | ②③④ | C. | ①②④ | D. | ①② |
3.下列实验操作中错误的是( )
| A. | 过滤时,玻璃棒应该紧靠三层滤纸处 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 蒸发结晶时应将溶液蒸干 | |
| D. | 称量时,称量物放在称量纸上置于托盘天平的左盘,砝码放在托盘天平的右盘中 |
4.下列叙述正确的是( )
| A. | 直径介于1-100nm之间的微粒称为胶体 | |
| B. | 氢氧化铁胶体是纯净物 | |
| C. | 利用丁达尔效应可以区别溶液和胶体 | |
| D. | 胶体粒子很小,可以透过半透膜 |
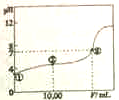 常温下,将0.1000mol.L-1NaOH溶液滴入20.00mL0.1000mol.L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示.
常温下,将0.1000mol.L-1NaOH溶液滴入20.00mL0.1000mol.L-1的一元酸HA溶液中,测得混合溶液的pH变化曲线如下图所示.