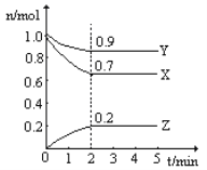
题目内容
【题目】据报导,目前我国结核病的发病率有抬头的趋势。抑制结核杆菌的药物除雷米封外,PAS—Na(对氨基水杨酸钠)也是其中一种。它与雷米封可同时服用,可以产生协同作用。已知:
①![]() (苯胺、弱碱性、易氧化)
(苯胺、弱碱性、易氧化)
②![]()
下面是PAS—Na的一种合成路线(部分反应的条件未注明):

按要求回答问题:
(写)出下列反应的化学方程式并配平
A→B:_______________________;
B→C7H6BrNO2:______________________;
(2)出下列物质的结构简式:C:____________________
D:______________________;
(3)出反应类型:II_______________,
(4)D→ E (反应III)所需条件_____________;
(5)写出C到D的化学反应方程式:________________。
【答案】 ![]() +HNO3
+HNO3![]()
![]() +H2O
+H2O ![]() +Br2
+Br2 ![]() HBr+
HBr+
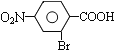
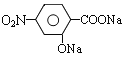 氧化 Fe、HCl、水
氧化 Fe、HCl、水 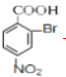 +3NaOH
+3NaOH![]()
 +NaBr+2H2O
+NaBr+2H2O
【解析】由对氨基水杨酸钠的结构可知A应为![]() ,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,由对氨基水杨酸钠中氨基与-COONa的位置可知,A发生甲基对位取代生成B,则B为
,与浓硝酸,在浓硫酸、加热条件下发生硝化反应生成B,由对氨基水杨酸钠中氨基与-COONa的位置可知,A发生甲基对位取代生成B,则B为![]() ,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C7H6BrNO2的结构简式为
,B与溴在Fe作催化剂条件下发生取代反应生成C,由对氨基水杨酸钠的结构可知,应发生甲基的邻位取代,故C7H6BrNO2的结构简式为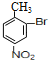 ,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应,
,由于酚羟基、氨基易被氧化,故生成C的反应应为氧化反应, 被酸性高锰酸钾氧化生成C,则C为
被酸性高锰酸钾氧化生成C,则C为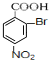 ,C在碱性条件下水解生成D为
,C在碱性条件下水解生成D为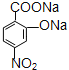 ,D在Fe、HCl、水条件下发生还原生成E,则E为
,D在Fe、HCl、水条件下发生还原生成E,则E为 ,E与碳酸氢钠反应生成氨基水杨酸钠;
,E与碳酸氢钠反应生成氨基水杨酸钠;
(1)A→B的反应方程式为:![]() ;
;
B→C7H6BrNO2的反应方程式为: ;
;
(2)由上述分析可知,C的结构简式为 ,D的结构简式为
,D的结构简式为 ;
;
(3)反应II是 被酸性高锰酸钾氧化生成
被酸性高锰酸钾氧化生成 ,反应类型为氧化反应;
,反应类型为氧化反应;
(4)由D→ E (反应III)是所需条件D在Fe、HCl、水条件下发生还原,将—NO2还原为—NH2,生成E;
(5) 在NaOH溶液中完全水解生成
在NaOH溶液中完全水解生成 ,其反应的化学反应方程式为
,其反应的化学反应方程式为 +3NaOH
+3NaOH![]()
 +NaBr+2H2O。
+NaBr+2H2O。

【题目】闪锌矿主要成分为ZnS,含少量FeS、CuS、CdS杂质。软锰矿的主要成分为 MnO2;含少量A12O3和SiO2。现以闪锌矿和软猛矿为原料制备Zn和MnO2,其简化流程如下(中间产物的固体部分已经略去)。

已知:I.矿石中所有金属元素在滤液中均以离子形式存在。
Ⅱ.各种金属离子完全沉淀的pH如下表:
Zn2+ | Mn2+ | Fe2+ | Fe,3+ | Al3+ | |
pH | 8.0 | 10.1 | 9.0 | 3.2 | 4.7 |
回答下列问题:
(1)步骤①中发生多个反应,其中MnO2、FeS与硫酸共热时有淡黄色物质析出,溶液变为棕黄色,写出MnO2、FeS与硫酸共热发生反应的化学方程式________________________________。
(2)步骤②加入金属锌是为了回收金属,回收金属的主要成分是_______________。
(3)步骤③与MnO2发生氧化还原反应的离子方程式_________________,物质X可以是__________(用字母表示。
A.Cu2(OH)2CO3 B.MnCO3 C. MgO D.Zn(OH)2
(4)流程中可以循环利用的物质是____________(填化学式)。
(5)MnO2与Li构成LiMnO2,该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。回答下列问题:

①外电路中的电子移动方向是由______极流向______极(填字母)。
②写出该锂离子电池的正极电极反应式_____________________________。
(6)已知:25℃时,HCN的电离常数K=4.9×10-10, H2S的电离常数K1=1.3×10-7 ,K2=7.0 ×10 -15,向NaCN溶液中通入少量的H2S气体,该反应的化学方程式为______________________。
【题目】某化学兴趣小组的同学们对SO2的有关反应进行实验探究:
【实验I】探究SO2催化氧化的反应:

(1)装置 A模拟工业生产中SO2催化氧化的反应,其化学方程式是_________________________。〇
(2)为检验反应后的气体成分,将上图装置依次连接的合理顺序为A、(按气流方向,用字母表示)_______。
(3)能证明气体中有SO2的实验现象是_____________,有SO3的实验现象是_____________。
【实验II】探究SO2与Fe(NO3)3,溶液的反应:
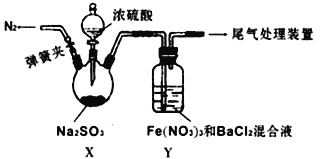
(4)X中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是 ___________________________。
(5)装置Y中产生了白色沉淀,其成分是_________;该研究小组对产生白色沉淀的原因进行了假设:
假设1:在酸性条件下SO2与NO3-反应;
假设2:SO2与Fe3+反应;
假设3:___________________________。
(6)某同学设计实验验证假设1,请帮他完成下表中内容。
实验步骤 | 现象和结论 |
①测定Y中混合溶液的pH; ②配制与步骤①有相同pH的________,并通入适量N2; ③将SO2通入步骤②中溶液。 | 若出现白色沉淀则假设1成立,若不出现白色沉淀则假设1不成立。 |
经验证假设1成立,则验证过程中发生反应的离子方程式是_______________(提示:此条件下未见气体产生)。