题目内容
10.将1.01g固体KNO3溶解在热的稀硫酸中,当加入30mL 0.5mol•L-1K2S溶液时,两者恰好反应完,放出NxOy气体,下列叙述正确的是( )| A. | 氧化剂与还原剂物质的量之比为3:2 | |
| B. | 当S2-全部转化成S时,x=1,y=2 | |
| C. | 反应转移0.03mol电子 | |
| D. | 当S2-全部转化成S和SO2时,氧化产物为0.015mol |
分析 1.01g固体KNO3的物质的量为$\frac{1.01g}{101g/mol}$=0.01mol,n(K2S)=0.5mol•L-1×0.03L=0.015mol,反应中N原子得电子,S原子失电子,
A.反应中KNO3作氧化剂,K2S为还原剂;
B.根据得失电子守恒计算;
C.不知道产物的化合价,无法计算;
D.根据S原子守恒计算.
解答 解:1.01g固体KNO3的物质的量为$\frac{1.01g}{101g/mol}$=0.01mol,n(K2S)=0.5mol•L-1×0.03L=0.015mol,反应中N原子得电子,S原子失电子,
A.反应中KNO3作氧化剂,K2S为还原剂,则氧化剂与还原剂物质的量之比为0.01mol:0.015mol=2:3,故A错误;
B.当S2-全部转化成S时,S元素失去的电子为0.015mol×2=0.03mol,则N元素得到0.03mol电子,NxOy中N的化合价为+a价,0.01mol×(5-a)=0.03mol则a=+2价,所以NxOy的化学式为NO,即x=1,y=1,故B错误;
C.不知道产物的化合价,无法计算转移的电子的物质的量,故C错误;
D.S原子失电子被氧化,则当S2-全部转化成S和SO2时,S和SO2为氧化产物,由S原子守恒可知,氧化产物为0.015mol,故D正确.
故选D.
点评 本题考查了氧化还原反应,侧重于氧化还原反应的概念、计算的考查,注意从化合价的角度分析,题目难度中等.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案
相关题目
1.下列化学用语书写正确的是( )
| A. | NH3的电子式为: | B. | 氯原子的结构示意图: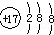 | ||
| C. | CO2结构式:O=C=O | D. | 乙烯的结构简式 CH2CH2 |
 (1)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题:
(1)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号.请回答下列问题: .
. .
. ,乙烷的结构简式CH3-CH3.
,乙烷的结构简式CH3-CH3. .
. ;
; ;
;
 ②H2O22H•+2
②H2O22H•+2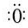 →
→ .
.