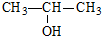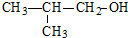题目内容
18.按要求填空(1)Cu的简化电子排布式[Ar]3d104s1.
(2)S的价电子排布式3s23p4.
(3)Fe的原子结构示意图
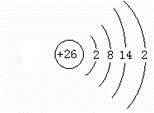 .
.(4)N的电子排布图为
 .
.(5)乙烯的结构式
 ,乙烷的结构简式CH3-CH3.
,乙烷的结构简式CH3-CH3.(6)Na2O2的电子式
 .
.
分析 (1)Cu为29号元素,原子核外电子数为29,其中3d能级达到全满;
(2)S为16号元素,原子核外电子数为16;
(3)Fe为26号元素,原子核外电子数为26;
(4)N原子核外有7个电子,分别位于1S、2S、2P轨道;
(5)乙烯的结构式中C-H不能省略,乙烷的结构简式C-H省略;
(6)首先判断化合物是离子化合物还是共价化合物;依据电子式的书写写出,即把原子的最外层电子表示出来;
若是离子化合物,其电子式由阴、阳离子的电子式组合而成,相同的离子不能合并;
若是共价化合物,其电子式由对应原子的电子式组成,并要表示出两原子之间的共用电子对情况
解答 解:(1)Cu为29号元素,原子核外电子数为29,其中3d能级达到全满,简化电子排布式为[Ar]3d104s1,故答案为:[Ar]3d104s1;
;
(2)S为16号元素,原子核外电子数为16,价电子排布式为3s23p4,故答案为:3s23p4;
(3)Fe为26号元素,原子核外电子数为26,则Fe的原子结构示意图 ,故答案为:
,故答案为: ;
;
(4)N原子核外有7个电子,分别位于1S、2S、2P轨道,其轨道表示式为 ,故答案为:
,故答案为: ;
;
(5)乙烯的结构式中C-H不能省略,则乙烯的结构式为: ,乙烷的结构简式C-H省略,则为CH3-CH3,故答案为:
,乙烷的结构简式C-H省略,则为CH3-CH3,故答案为: ;CH3-CH3;
;CH3-CH3;
(6)Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ,
,
故答案为: ;
;
点评 本题考查较为综合,考查核外电子排布规律、电子式、核外电子排布式(图)的书写等,侧重于原子结构、原子核外电子排布规律的应用,题目难度中等.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
9.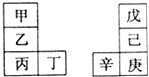 甲~辛等八种元素在周期表中的相对应位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁是辛属同周期元素,下列判断不正确的是
甲~辛等八种元素在周期表中的相对应位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁是辛属同周期元素,下列判断不正确的是
( )
 甲~辛等八种元素在周期表中的相对应位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁是辛属同周期元素,下列判断不正确的是
甲~辛等八种元素在周期表中的相对应位置如表.甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁是辛属同周期元素,下列判断不正确的是( )
| A. | 乙的单质在空气中燃烧生成只含离子键的化合物 | |
| B. | 原子半径:辛>已>戊 | |
| C. | 最高价氧化物对应的水化物的碱性:丙>乙>甲 | |
| D. | 丙与庚的原子核外电子数相差13 |
6.若在恒温恒容的容器内进行反应C(s)+H2O(g)?CO(g)+H2(g).则可用来判断该反应达到平衡状态的标志有( )
| A. | 容器中H2O浓度与CO浓度相等 | |
| B. | 容器中H2浓度与CO浓度相等 | |
| C. | 容器中混合气体的密度保持不变 | |
| D. | CO的生成速率与H2O的消耗速率相等 |
3. 《Nature》报道了我国科学家通过测量化石中26AI和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”.回答下列问题:
《Nature》报道了我国科学家通过测量化石中26AI和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”.回答下列问题:
(1)9Be和10BeCD(填字母).
A.是同一种原子 B.具有相同的中子数
C.具有相同的化学性质 D.自然界中具有恒定的含量
(2)Al和Be具有相似的化学性质,写出Be与NaOH溶液反应的化学方程式:Be+2NaOH═Na2BeO2+H2↑.
(3)研究表明26AI可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是BC(填字母).
A.比较这两种元素的单质的硬度和熔点
B.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
C.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
D.将空气中放置已久的这两种元素的单质分别和热水作用
(4)为了证明:氮、碳、硅的非金属性依次减弱,请你设计实验.
供选择的药品有:1mol•L-1的硝酸溶液、1mol•L-1的硫酸溶液、碳酸钙、碳酸钠固体、0.5mol•L-1的硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液、漂白粉溶液.供选择的仪器如图 (仪器可重复使用):
在便于控制反应的前提下,选择仪器和药品按气流从上至下顺序填表(可不填满,也可补充):
 《Nature》报道了我国科学家通过测量化石中26AI和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”.回答下列问题:
《Nature》报道了我国科学家通过测量化石中26AI和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法”.回答下列问题:(1)9Be和10BeCD(填字母).
A.是同一种原子 B.具有相同的中子数
C.具有相同的化学性质 D.自然界中具有恒定的含量
(2)Al和Be具有相似的化学性质,写出Be与NaOH溶液反应的化学方程式:Be+2NaOH═Na2BeO2+H2↑.
(3)研究表明26AI可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是BC(填字母).
A.比较这两种元素的单质的硬度和熔点
B.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
C.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
D.将空气中放置已久的这两种元素的单质分别和热水作用
(4)为了证明:氮、碳、硅的非金属性依次减弱,请你设计实验.
供选择的药品有:1mol•L-1的硝酸溶液、1mol•L-1的硫酸溶液、碳酸钙、碳酸钠固体、0.5mol•L-1的硅酸钠溶液、澄清石灰水、饱和碳酸氢钠溶液、漂白粉溶液.供选择的仪器如图 (仪器可重复使用):
在便于控制反应的前提下,选择仪器和药品按气流从上至下顺序填表(可不填满,也可补充):
| 仪器代号 | 所装试剂 | 装置作用 |
| A | 石灰石和1mol/L硝酸. | 制取CO2证明硝酸比碳酸强 |
| C | 饱和碳酸氢钠溶液 | 除去CO2中的硝酸蒸气 |
| C | 硅酸钠溶液 | 证明碳酸强于硅酸 |
10.将1.01g固体KNO3溶解在热的稀硫酸中,当加入30mL 0.5mol•L-1K2S溶液时,两者恰好反应完,放出NxOy气体,下列叙述正确的是( )
| A. | 氧化剂与还原剂物质的量之比为3:2 | |
| B. | 当S2-全部转化成S时,x=1,y=2 | |
| C. | 反应转移0.03mol电子 | |
| D. | 当S2-全部转化成S和SO2时,氧化产物为0.015mol |
7.Na2O和Na2O2的混合物共0.1mol溶于水后,刚好被100g7.3%的盐酸中和,则混合物中Na2O和Na2O2的物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 3:4 | D. | 任意比 |