题目内容
2.实验室需要450mL 1.0mol•L-1的硫酸溶液,某小组的同学设计如下实验步骤并依此进行配制,请回答相关问题(已知所用98%浓硫酸的密度为1.84g•cm-3)①计算需98%的浓硫酸多少毫升?②在烧杯中将浓硫酸稀释③接着讲稀释后的硫酸转移到容量瓶中;④洗涤烧杯和玻璃棒3次,并将洗涤液转移到容量瓶中;⑤定容;⑥摇匀.
(1)该小组选用200mL和250mL的容量瓶各一个,你认为不正确(填“正确”或“不正确”);如填不正确,应选1个500mL(指出规格和个数)的容量瓶,并请说出你的理由容量瓶的容量应略大于或等于所要配制的溶液量.(如填正确,后两问可不作回答).
(2)按照你选取的容量瓶,应该用50mL(多大规格)的量筒(可供选择的量筒规格为:10mL、15mL、20mL、50mL和100mL),量取27.2mL98%的浓硫酸.
(3)量筒和容量瓶在使用前都已洗干净但不干燥,对结果是否造成影响,请具体回答前者会使浓度偏低,或者无影响;某同学认为将量筒内浓硫酸倒出之后,应将量筒洗涤一下并将洗涤液倒入烧杯中,最后转移到容量瓶中,你认为错误(填“正确”或“错误”).
(4)配制好的溶液要等到下周高一同学的实验课上使用,该小组同学认为保存在容量瓶里就行,你怎样认为?如果你是该小组的成员,请谈谈你的看法和做法容量瓶为精密仪器,不能用来长期存储液体,应将液体转移到试剂瓶中.
(5)指出上述操作步骤中的疏漏之处稀释后应冷却到室温,该处疏漏可造成所配溶液浓度偏大(填“偏大”或“偏小”)
分析 (1)需要450mL 1.0mol•L-1的硫酸溶液,应选择500mL容量瓶;
(2)根据c=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度,再根据溶液稀释前后物质的量不变计算所需浓硫酸的体积;依据溶液体积选择合适的量筒;
(3)分析量筒和容量瓶在使用前都已洗干净但不干燥,对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;依据量筒使用方法解答;
(4)依据容量瓶使用注意问题解答;
(5)依据配制一定物质的量浓度溶液的一般步骤解答.
解答 解:(1)选择容量瓶的原则:容量瓶的容量应略大于或等于所要配制的溶液量,需要450mL 1.0mol•L-1的硫酸溶液,应选择500mL容量瓶,选用200mL和250mL的容量瓶需要配制2次,误差较大;
故答案为:不正确;1个500mL;容量瓶的容量应略大于或等于所要配制的溶液量;
(2)98%浓硫酸的密度为1.84g•cm-3,其物质的量浓度=$\frac{1000×1.84×98%}{98}$=18.4mol/L,设需要浓硫酸体积为V,则根据溶液稀释前后物质的量不变,V×18.4mol/L=1.0mol•L-1×500mL,解得V=27.2mL,所以应选择50mL量筒;
故答案为:50mL;27.2;
(3)量筒和在使用前已洗干净但不干燥,将浓硫酸稀释,量取的硫酸的物质的量偏小,溶液的浓度偏低;
容量瓶在使用前已洗干净但不干燥,对溶质的物质的量和溶液体积不会产生影响溶液浓度不变;
不能洗涤量筒,否则若洗涤量取浓H2SO4后的量筒,并将洗涤液转移到容量瓶中,会导致配制的溶液浓度偏高;
故答案为:前者会使浓度偏低,或者无影响;
(4)容量瓶为精密仪器,不能用来长期存储液体,应将液体转移到试剂瓶中;
故答案为:容量瓶为精密仪器,不能用来长期存储液体,应将液体转移到试剂瓶中;
(5)溶液稀释后应冷却到室温再进行移液,如果未冷却,定容后,冷却到室温,溶液体积减小,溶液浓度偏大;
故答案为:稀释后应冷却到室温;偏大.
点评 本题考查了配制一定物质的量浓度溶液,侧重考查学生对容量瓶、量筒的选择,实验误差的分析,明确实验原理和过程是解题关键,题目难度不大.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 柠檬酸钠 | B. | 氧化镁 | C. | 氢氧化铝 | D. | 纯碱 |
| A. | 氧化剂与还原剂物质的量之比为3:2 | |
| B. | 当S2-全部转化成S时,x=1,y=2 | |
| C. | 反应转移0.03mol电子 | |
| D. | 当S2-全部转化成S和SO2时,氧化产物为0.015mol |
| A. | 1:1 | B. | 2:1 | C. | 3:4 | D. | 任意比 |
| A. | 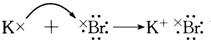 | |
| B. |  | |
| C. | 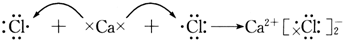 | |
| D. |  |