题目内容
(16分)尿素[CO(NH2)2]是首个由无机物人工合成的有机物。
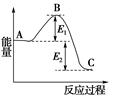
⑴工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为 。
⑵当氨碳比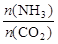 =4时,CO2的转化率随时间的变化关系如右图所示。
=4时,CO2的转化率随时间的变化关系如右图所示。
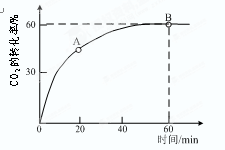
①A点的逆反应速率v逆(CO2) B点的正反应速率v正(CO2)(填 “大于”、“小于”或“等于”)
②NH3的平衡转化率为 。
⑶人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如右图。
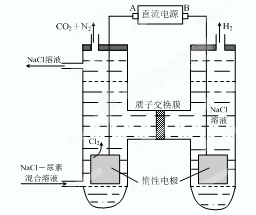
①电源的负极为 (填“A”或“B”)。
②阳极室中发生的反应依次为 、 。
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
⑴工业上尿素由CO2和NH3在一定条件下合成,其反应方程式为 。
⑵当氨碳比
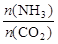 =4时,CO2的转化率随时间的变化关系如右图所示。
=4时,CO2的转化率随时间的变化关系如右图所示。
①A点的逆反应速率v逆(CO2) B点的正反应速率v正(CO2)(填 “大于”、“小于”或“等于”)
②NH3的平衡转化率为 。
⑶人工肾脏可采用间接电化学方法除去代谢产物中的尿素,原理如右图。

①电源的负极为 (填“A”或“B”)。
②阳极室中发生的反应依次为 、 。
③电解结束后,阴极室溶液的pH与电解前相比将 ;若两极共收集到气体13.44 L(标准状况),则除去的尿素为 g(忽略气体的溶解)。
(1)2NH3+CO2 CO(NH2)2+H2O (2)①小于 ②30%
CO(NH2)2+H2O (2)①小于 ②30%
(3)①B ②2Cl--2e-=Cl2↑ CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl ③不变 7.2
 CO(NH2)2+H2O (2)①小于 ②30%
CO(NH2)2+H2O (2)①小于 ②30%(3)①B ②2Cl--2e-=Cl2↑ CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl ③不变 7.2
(1)根据反应物和生成物可知,反应的方程式是2NH3+CO2 CO(NH2)2+H2O。
CO(NH2)2+H2O。
(2)①根据图像可知,B点CO2的转化率不再发生变化,所以是平衡状态。因此A点没有达到平衡状态,因此A点的逆反应速率小于B的点的正反应速率;如果设CO2的物质的量是1mol,则氨气是4mol。根据图像可知,CO2的转化率是0.6,则消耗CO2是0.6mol,所以消耗氨气是1.2mol,因此氨气的转化率是1.2÷4=0.3,即30%。
(3)①根据装置图可知,和电源B极相连的产生氢气,所以该电极是阴极,氢离子放电,所以B是电源的负极,A是正极。
②阳极失去电子,所以溶液中的氯离子放电,生成氯气。氯气具有氧化性,能氧化尿素生成氮气和CO2,方程式分别是2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。
 CO(NH2)2+H2O。
CO(NH2)2+H2O。(2)①根据图像可知,B点CO2的转化率不再发生变化,所以是平衡状态。因此A点没有达到平衡状态,因此A点的逆反应速率小于B的点的正反应速率;如果设CO2的物质的量是1mol,则氨气是4mol。根据图像可知,CO2的转化率是0.6,则消耗CO2是0.6mol,所以消耗氨气是1.2mol,因此氨气的转化率是1.2÷4=0.3,即30%。
(3)①根据装置图可知,和电源B极相连的产生氢气,所以该电极是阴极,氢离子放电,所以B是电源的负极,A是正极。
②阳极失去电子,所以溶液中的氯离子放电,生成氯气。氯气具有氧化性,能氧化尿素生成氮气和CO2,方程式分别是2Cl--2e-=Cl2↑、CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl。

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
 4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
4NO2(g)+O2(g);△H>0。反应至5分钟时各物质的浓度不再发生变化,测得NO2的体积分数为50%。
 N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1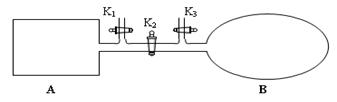
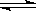 CH3OH(g) ΔH< 0。
CH3OH(g) ΔH< 0。
 CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ;
CO(g)+H2(g),此反应是吸热反应。①此反应的化学平衡常数表达式为 ; CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)
CO (g)+2H2O (g) +519KJ。工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同)