题目内容
18.常温下,下列各组离子在指定溶液中能大量共存的是( )| A. | pH=1的溶液:Na+、Fe3+、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| B. | 滴入甲基橙呈红色的溶液中:K+、HCO${\;}_{3}^{-}$、Cl-、CO${\;}_{3}^{2-}$ | |
| C. | c(OH-)=1.0×10-13mol•L-1的溶液中:SO${\;}_{3}^{2-}$、SiO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、K+ | |
| D. | c(I-)=0.1 mol•L-1的溶液中:Na+、NH${\;}_{4}^{+}$、ClO-、SO${\;}_{4}^{2-}$ |
分析 A.pH=1的溶液中存在大量氢离子,四种离子之间不反应,都不与氢离子反应;
B.滴入甲基橙呈红色的溶液为酸性溶液,溶液中存在大量氢离子,碳酸氢根离子、碳酸根离子与氢离子反应;
C.c(OH-)=1.0×10-13mol•L-1的溶液为酸性溶液,溶液中存在大量氢离子,氢离子与硅酸根离子、亚硫酸根离子反应,硝酸根离子在酸性条件下能够氧化亚硫酸根离子;
D.次氯酸根离子具有强氧化性,能够氧化碘离子.
解答 解:A.Na+、Fe3+、NO3-、SO42-之间不发生反应,都不与氢离子反应,在溶液中能够大量共存,故A正确;
B.滴入甲基橙呈红色的溶液中存在大量氢离子,CO32-、HCO3-都与氢离子反应,在溶液中不能大量共存,故B错误;
C.c(OH-)=1.0×10-13mol•L-1的溶液中存在大量氢离子,SO32-、SiO32-与氢离子反应,且NO3-在酸性条件下能够氧化SO32-,在溶液中不能大量共存,故C错误;
D.I、ClO-之间发生氧化还原反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的正误判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
相关题目
15.据科学家预测,月球的土壤中吸附着数百万吨的${\;}_{2}^{3}$He,每百吨${\;}_{2}^{3}$He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上氦元素主要以${\;}_{2}^{4}$He的形式存在.下列说法正确的是( )
| A. | ${\;}_{2}^{4}$He原子核内含有4个质子 | B. | ${\;}_{2}^{3}$He原子核内含有3个中子 | ||
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | D. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同素异形体 |
10.反应2SO2+O2?2SO3在密闭容器中进行.下列关于该反应的说法错误的是( )
| A. | 升高温度能加快反应速率 | B. | 使用恰当的催化剂能加快反应速率 | ||
| C. | 增大O2的浓度能加快反应速率 | D. | SO2与O2能100%转化为SO3 |
7.下表是A、B、C、D四种有机物的有关信息.
请回答下列问题.
(1)写出有机物C的结构简式HCOOH.
(2)写出B→D的化学反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(3)写出A与NH3在一定条件下反应生成丙烯酰胺的化学方程式,并指出反应类型:CH2=CHCOOH+NH3→CH2=CHCOONH2+H2O,反应类型取代反应.
(4)丙烯酰胺有多种同分异构体,试写出分子中同时含有醛基和碳碳双键的3种同分异构体的结构简式CH2=CHNHCHO、CH2=C(NH2)CHO、CH(NH2)=CHCHO.
| A | 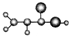 ①由C、H、O三种元素组成 ②球棍模型为: ③能与NH3在一定条件下反应生成丙烯酰胺CH2=CHCONH2 ④相对分子质量为72 |
| B | ①由C、H、O三种元素组成 ②能与Na反应,但不能与NaOH溶液反应 ③能与A反应生成相对分子质量为100的酯 |
| C | ①相对分子质量与B相同 ②能被新制的氢氧化铜悬浊液氧化 ③能与NaHCO3溶液反应放出CO2气体 |
| D | ①能使溴的四氯化碳溶液褪色 ②能与水在一定条件下反应生成B |
(1)写出有机物C的结构简式HCOOH.
(2)写出B→D的化学反应方程式CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O.
(3)写出A与NH3在一定条件下反应生成丙烯酰胺的化学方程式,并指出反应类型:CH2=CHCOOH+NH3→CH2=CHCOONH2+H2O,反应类型取代反应.
(4)丙烯酰胺有多种同分异构体,试写出分子中同时含有醛基和碳碳双键的3种同分异构体的结构简式CH2=CHNHCHO、CH2=C(NH2)CHO、CH(NH2)=CHCHO.
8.0.1mol NaHCO3中含有( )
| A. | 0.2mol Na+ | B. | 0.05mol CO${\;}_{3}^{2-}$ | ||
| C. | 6.02×1023个O | D. | 0.1mol H |
 阿司匹林(又称乙酰水杨酸,
阿司匹林(又称乙酰水杨酸, 是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为:
是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128-135℃.某学习小组在实驻室以水杨酸(邻羟基苯甲酸)与乙酸酐[(CH3CO)2O]为主要原料合成阿司匹林,其制备原理为: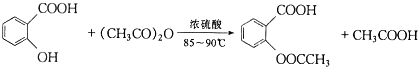
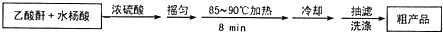

 有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示:
有机物A是石油裂解的主要产物之一,其标准状况下的密度为1.25g/L.反应⑦能缓解目前一个重要的环境问题,生成的聚合物G(C3H4O3)n是一种可降解塑料.有关转化关系如图所示: +CaCl2+2H2O.
+CaCl2+2H2O.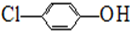 ),其原理如图1所示.
),其原理如图1所示.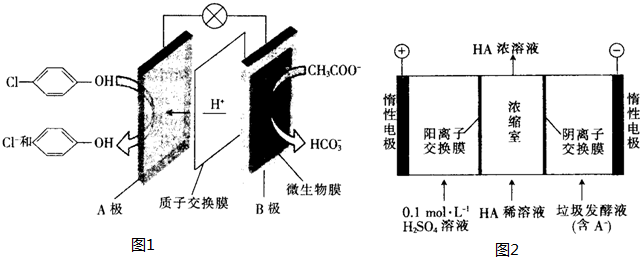
 -OH+2e-+H+═
-OH+2e-+H+═ -OH+Cl-.
-OH+Cl-.