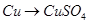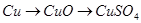题目内容
研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
将含有SO2的废气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,在废气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间的二氧化碳,以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(2)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
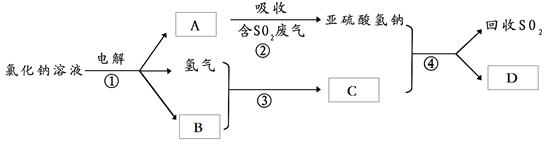 工业生产中,步骤③的反应条件为 。
工业生产中,步骤③的反应条件为 。
该工艺中物质D可以作为原料循环利用,它的化学式为 。
写出步骤②反应的离子方程式 。
(3)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_ 。
(4)工业上常用Na2CO3溶液处理氮的氧化物。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
现用足量的Na2CO3溶液完全吸收NO和NO2的混合气体8.96L,混合气体中NO和NO2的体积比为1:3,则吸收过程中产生气体在标准状况下的体积为 。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
| A.温室效应 | B.酸雨 | C.粉尘污染 | D.水体富营养化 |
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(2)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
 工业生产中,步骤③的反应条件为 。
工业生产中,步骤③的反应条件为 。该工艺中物质D可以作为原料循环利用,它的化学式为 。
写出步骤②反应的离子方程式 。
(3)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_ 。
(4)工业上常用Na2CO3溶液处理氮的氧化物。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
现用足量的Na2CO3溶液完全吸收NO和NO2的混合气体8.96L,混合气体中NO和NO2的体积比为1:3,则吸收过程中产生气体在标准状况下的体积为 。
(1)ABC(2分 漏选扣1分)
Ca(HCO3)2或碳酸氢钙
Ca(HSO3)2+O2=CaSO4+H2SO4
(2)点燃 NaCl SO2+OH—= HSO3—
(3)3NO2+H2O=2HNO3+NO
2NO+2CO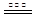 N2+2CO2
N2+2CO2
(4)4.48L(4分)
Ca(HCO3)2或碳酸氢钙
Ca(HSO3)2+O2=CaSO4+H2SO4
(2)点燃 NaCl SO2+OH—= HSO3—
(3)3NO2+H2O=2HNO3+NO
2NO+2CO
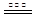 N2+2CO2
N2+2CO2(4)4.48L(4分)
试题分析:(1)SO2引起酸雨 、CO2能引起温室效应、PM2.5粉尘污染等故答案选择ABC。被氧化的方程式为Ca(HSO3)2+O2=CaSO4+H2SO4 工业生产盐酸的反应条件为点燃,亚硫酸氢钠和盐酸反应生成了氯化钠和二氧化硫。步骤②反应的离子方程式SO2+OH—= HSO3—。
(3)NO2转化为HNO3的化学方程式3NO2+H2O=2HNO3+NO。根据题信息,写出NO被CO还原的化学方程式2NO+2CO
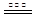 N2+2CO2。(4)NO和NO2的混合气体8.96L物质的量为0.4mol,又混合气体中NO和NO2的体积比为1:3,则NO,NO2分别为0.1mol,0.3mol。根据已知方程式NO + NO2 + Na2CO3 = 2NaNO2 + CO2,NO2还剩下0.2mol,发生了第二个反应 2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2生成了二氧化碳0.1mol,故吸收过程中产生气体在标准状况下的体积为4.48L。
N2+2CO2。(4)NO和NO2的混合气体8.96L物质的量为0.4mol,又混合气体中NO和NO2的体积比为1:3,则NO,NO2分别为0.1mol,0.3mol。根据已知方程式NO + NO2 + Na2CO3 = 2NaNO2 + CO2,NO2还剩下0.2mol,发生了第二个反应 2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2生成了二氧化碳0.1mol,故吸收过程中产生气体在标准状况下的体积为4.48L。
练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目