题目内容
16.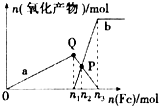 含1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )
含1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物与铁粉物质的量的关系如图所示(已知稀硝酸的还原产物只有NO).下列有关判断正确的是( )| A. | 曲线a表示Fe2+,曲线b表示Fe3+ | |
| B. | P点时总反应的离子方程式可表示为5Fe+16H++NO3-═3Fe2++2Fe3++4NO↑+8H2O | |
| C. | n2=0.25 | |
| D. | n3:n1=3:2 |
分析 向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,当铁过量时,过量的铁再与 Fe(NO3)3反应生成 Fe(NO3)2,2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,参加反应的硝酸为1mol,利用方程式计算出 Fe(NO3)3为0.25mol,可求n1.
解答 解:A、向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为4mol利用方程式可计算出生成的 Fe(NO3)3为1mol,所以参加反应的硝酸为1mol即n1=0.25,a表示Fe(NO3)3,故A错误;
B、Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,随后是Fe(NO3)3 与过量的铁继续反应生成 Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe=3 Fe(NO3)2,P点为 Fe(NO3)3 与 Fe(NO3)2物质的量相等的点,故B错误;
C、根据铁原子守恒,n(Fe)=n(Fe(NO3)2)+n(Fe(NO3)),所以 n(Fe)=0.3mol,即n2=0.3mol,故C错误;
D、向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为1mol利用方程式可计算出生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,将0.25mol的 Fe(NO3)3转化为 Fe(NO3)2需要的金属铁是0.125mol,所以n3=0.25mol+0.125mol=0.375mol,n3:n1=3:2,故D正确.
故选D.
点评 本题考查了铁与稀硝酸的反应,要注意铁和硝酸谁多谁少,以及加入的顺序,难度较大.

| A. | 野火烧不尽,春风吹又生 | B. | 春蚕到死丝方尽,蜡炬成灰泪始干 | ||
| C. | 爆竹声中一岁除,春风送暖入屠苏 | D. | 粉身碎骨浑不怕,要留清自在人间 |
| A. | H2SO4→SO2 | B. | Zn2+→Zn | C. | H2O→H2 | D. | CuO→CuCl2 |
| A. | X的最高价氧化物对应的水化物是弱酸 | |
| B. | Z位于元素周期表的第3周期第ⅥA族 | |
| C. | Y的最高氧化物对应的水化物能溶于NaOH溶液 | |
| D. | 原子半径的大小顺序:r(Z)>r(Y)>r(X) |
| A. | 活性炭去除冰箱中的异味 | B. | 食醋除水垢 | ||
| C. | 漂粉精作消毒剂 | D. | 铁粉作食品袋内的脱氧剂 |
| A. | 1.5 mol•L-1 | B. | 1 mol•L-1 | C. | 0.15 mol•L-1 | D. | 3 mol•L-1 |
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10mL | 18.60mL |
| 第二次 | 0.30mL | 18.00mL |
(2)达到滴定终点的标志是无色变粉红色且30s不变色.
(3)以下操作造成测定结果偏高的原因可能是ADE.
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.