题目内容
【题目】如下图所示,甲、乙为相互串联的两电解池。
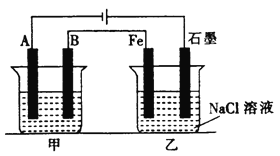
试回答:
(1)乙池中Fe电极为____________极。若在乙池中滴入少量酚酞试液,开始电解一段时间后,铁电极附近呈_____________色。
(2)甲池若为精炼铜(假设粗铜的组成是均匀的,且其中活泼和不活泼的成份均存在)的装置,则电解质溶液可以是________________;通过一段时间后,A电极增重12.8g,则乙池石墨电极放出的气体在标准状况下的体积为_____________。
【答案】阴红CuSO4溶液4.48L
【解析】
根据电解池的电极与外接电源的关系,可知A为阴极,B为阳极,Fe为阴极,石墨为阳极,结合电解池的工作原理和电解规律分析可得结论。
(1)乙池中Fe极电极反应式为2H++2e-=H2↑,在乙池中滴入少量酚酞试液,开始电解一段时间,由于水提供的H+在阴极(Fe)放电,OH-浓度增大,溶液呈碱性,铁极附近呈红色,故答案为:阴、红;
(2)若甲为精炼铜的装置,则电解质溶液用含Cu2+的溶液,如CuSO4溶液;A极上Cu2+放电,电极反应式为:Cu2++2e-=Cu,当A电极增重12.8g时,转移电子的物质的量为:12.8g÷64g/mol×2=0.4mol,根据电子守恒可知乙池中石墨电极氯离子放电产生氯气为:0.4mol÷2=0.2mol,体积为:0.2mol×22.4L/mol=4.48L,故答案为:CuSO4溶液、4.48L。

【题目】将5 mL 0.005 mol·L-1 FeCl3溶液和5 mL 0.015 mol·L-1 KSCN溶液混合。达到平衡后溶液呈红色。再将混合液等分为5份,分别进行如下实验:
| 实验①:滴加4滴水,振荡 |
实验②:滴加4滴饱和FeCl3溶液,振荡 | |
实验③:滴加4滴1 mol·L-1 KCl溶液,振荡 | |
实验④:滴加4滴1 mol·L-1 KSCN溶液,振荡 | |
实验⑤:滴加4滴6 mol·L-1 NaOH溶液,振荡 |
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加生成物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
【题目】下表各组物质之间通过一步反应不可以实现如下图所示转化关系的是
选项 | X | Y | Z | 对应过程的反应条件 |
A | SiO2 | Na2SiO3 | H2SiO3 | ①Na2CO3熔融 |
B | NaOH | NaHCO3 | Na2CO3 | ②加热 |
C | N2 | NO2 | HNO3 | ③加热 |
D | C | CO | CO2 | ④灼热炭粉 |
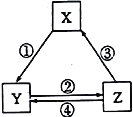
A. A B. B C. C D. D
【题目】在温度相同、容积均为2 L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下。下列说法正确的是
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mo N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3浓度(mol/L) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
A. 2p1=2p3<p2 B. 达到平衡时丙容器中NH3的体积分数最大
C. α2+α3<1 D. Q1+Q3=92.4
