题目内容
(16分)炼锌厂产生的工业废渣——锌渣(除了含Zn外,还含有Fe、Al和SiO2等杂质),利用锌渣制取并回收ZnSO4·7H2O和金属镉是一个有益的尝试,其流程如下:
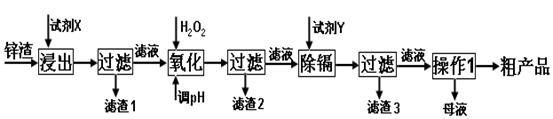
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强;SiO2是不溶于水和酸(HF除外)的酸性氧化物。
试回答下列问题:
(1)“浸出”时用到的“试剂X” 选 。
A.H2SO4(aq) B.HCl(aq) C.HNO3(aq)
“滤渣1”的主要成分是 _(填化学式)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。
A.H2SO4 B.ZnO C.NaOH
(4)“试剂Y” 选______________。
A.Cd B.Zn C.Fe
(5)“操作1”的方法是_____、______、_______。

已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7;锌的金属活动性比镉强;SiO2是不溶于水和酸(HF除外)的酸性氧化物。
试回答下列问题:
(1)“浸出”时用到的“试剂X” 选 。
A.H2SO4(aq) B.HCl(aq) C.HNO3(aq)
“滤渣1”的主要成分是 _(填化学式)。
(2)写出“氧化”过程的离子方程式 。
(3)“调pH”过程可以选用 。
A.H2SO4 B.ZnO C.NaOH
(4)“试剂Y” 选______________。
A.Cd B.Zn C.Fe
(5)“操作1”的方法是_____、______、_______。
(16分)每空2分 (1)A(H2SO4溶液); SiO2 (2)2H++H2O2+2Fe2+ =2Fe3++2H2O
(3)B(ZnO) (4)B(Zn) (5)加热浓缩、蒸发结晶、过滤(洗涤)
(3)B(ZnO) (4)B(Zn) (5)加热浓缩、蒸发结晶、过滤(洗涤)
(1)由于是制取硫酸锌晶体的,所以应该用稀硫酸,答案选A。二氧化硅不溶于水,所以滤渣是二氧化硅。
(2)双氧水是来氧化亚铁离子的,由于双氧水的还原产物是水,所以方程式为2H++H2O2+2Fe2+ =2Fe3++2H2O。
(3)由于不能引入新的杂质,所以有关选择氧化锌,答案选B。
(4)锌的金属活动性比镉强,所以要置换出镉,又不能引入杂质,有关选择锌,答案选B。
(5)要从溶液中中得到硫酸锌晶体,应该是通过加热浓缩、蒸发结晶,然后过滤,洗涤即可。
(2)双氧水是来氧化亚铁离子的,由于双氧水的还原产物是水,所以方程式为2H++H2O2+2Fe2+ =2Fe3++2H2O。
(3)由于不能引入新的杂质,所以有关选择氧化锌,答案选B。
(4)锌的金属活动性比镉强,所以要置换出镉,又不能引入杂质,有关选择锌,答案选B。
(5)要从溶液中中得到硫酸锌晶体,应该是通过加热浓缩、蒸发结晶,然后过滤,洗涤即可。

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目