题目内容
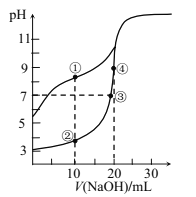
【题目】已知:25℃时,Kb(NH3·H2O)=1.8×10-5。该温度下,用0.100mol·L-1氨水滴定10.00mL0.100mol·L-1一元酸HA的溶液.滴定过程中加入氨水的体积(V)与溶液中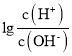 的关系如图所示。下列说法不正确的是
的关系如图所示。下列说法不正确的是

A.HA为强酸
B.a=10
C.M点时,c(A-)>c(NH4+)>c(H+)>c(OH-)
D.当滴入20mL氨水时,溶液中存在c(NH4+)>c(A-)
【答案】B
【解析】
A选项,根据图中信息![]() =12,则氢离子浓度为0.100mol·L-1,因此HA为强酸,故A正确;
=12,则氢离子浓度为0.100mol·L-1,因此HA为强酸,故A正确;
B选项,a=10,则溶质为NH4A,溶液显酸性,因此![]() ,则
,则![]() ,与图像不符,故B错误;
,与图像不符,故B错误;
C选项,M点时,![]() ,经过计算氢离子约为1×10-5.25 mol·L-1,因此浓度c(A)>c(NH4+)>c(H+)>c(OH),故C正确;
,经过计算氢离子约为1×10-5.25 mol·L-1,因此浓度c(A)>c(NH4+)>c(H+)>c(OH),故C正确;
D选项,当滴入20mL氨水时,溶质为NH3·H2O和NH4A,氨水电离为主,因此溶液中存在c(NH4+)>c(A),故D正确。
综上所述,答案为B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目