题目内容
【题目】BMO(Bi2MoO6)是一种高效光催化剂,可用于光催化降解苯酚,原理如图所示。下列说法正确的是
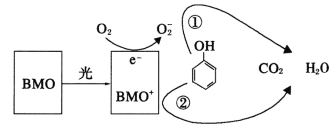
A.该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O
6CO2+3H2O
B.该过程中BMO表现出较强氧化性
C.光催化降解过程中,光能转化为化学能、热能等
D.①和②中被降解的苯酚的物质的量之比为1:3
【答案】AC
【解析】
A选项,根据图中信息得到该过程的总反应:C6H6O+7O2![]() 6CO2+3H2O,故A正确;
6CO2+3H2O,故A正确;
B选项,BMO与氧气氧化成变为BMO+,说明该过程中BMO表现出较强还原性,故B错误;
C选项,光催化降解过程中,光能转化为化学能、热能等,故C正确;
D选项,根据O2-与BMO+得失电子关系,O2-化合价失去三个得到氧离子,BMO+化合价降低一个价态,因此①和②中被降解的苯酚的物质的量之比为3:1,故D错误。
综上所述,答案为AC。

【题目】如图所示装置中观察到电流计指针偏转,M棒变粗,N棒变细,指针指向M,由此判断下表中所列M、N、P物质,其中可以成立的组合是( )
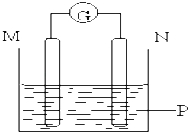
M | N | P | |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.A B.B C.C D.D
【题目】有a、b、c、d四个金属电极,有关的实验装置及部分实验现象如下:
实验装置 |
|
|
部分实验现象 | a极质量减小b极质量增加 | b极有气泡产生c极无变化 |
实验装置 |
|
|
部分实验现象 | d极溶解c极有气泡产生 | 电流从a极流向d极 |
由此判断这四种金属的活动性顺序是( )
A. a>b>c>dB. d>a>b>cC. b>c>d>aD. a>b>d>c
【题目】高铁酸钠(Na2FeO4)是水处理过程中常用的一种新型净水剂,在反应中被还原成Fe3+离子,工业上常用NaClO氧化Fe(OH)3生产高铁酸钠:
完成下列填空:
(1)配平上述化学方程式:___ Fe(OH)3 + ___ NaClO + ___ NaOH → ____ Na2FeO4 +___ NaCl +___ H2O
(2)其中发生还原反应的元素是__________;若制备过程中消耗了0.15 mol NaClO,则转移的电子数目是____________________。
(3)高铁酸钠之所以能净水,除了能杀菌消毒外,另一个原因是(结合离子方程式回答)_________________________________________________。
(4)生产高铁酸钠的另一种方法是电解法,原理是Fe + 2NaOH + 2 H2O → Na2FeO4 + 3 H2↑
则电解过程中Fe在_________。(选填编号)
a. 阳极发生氧化反应 b. 阴极发生还原反应
c. 阳极发生还原反应 d. 阴极发生氧化反应
(5)某地海水样品经Na2FeO4处理后,所含离子及其浓度如下表所示(H+和OH-未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度(mol/L) | a | 0.05 | 0.10 | 0.50 | 0.58 |
表格中的a_______0.16 (填“>”、“<”或“=”),判断的理由是______________________。