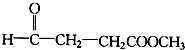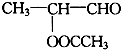题目内容
1.A~D是几种烃的分子球棍模型(如图所示),据此回答下列问题: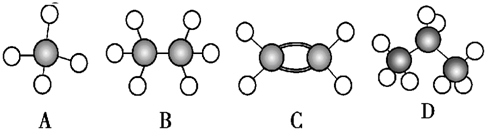
(1)A的结构式为:

(2)常温下含碳量最高的是C;
(3)C物质能和溴水反应,其反应方程式为:CH2=CH2+Br2→CH2Br-CH2Br反应类型为:加成反应
(4)A的同系物中相对分子质量为58的烷烃的分子式为C4H10
(5)将59gB和C的混合气体通入足量的溴水后,溴水增重14g,则混合气体中C的体积分数是25%.
分析 (1)A为甲烷的球棍模型,甲烷为正四面体结构,其分子中含有4个C-H键,据此写出甲烷的结构式;
(2)烃类物质中,烯烃的含碳量大于烷烃,四种物质中ABD为烷烃,C为烯烃;
(3)C表示的为乙烯,乙烯分子中含有官能团碳碳双键,能够与溴水发生加成反应生成1,2-二溴乙烷,据此写出反应方程式;
(4)设烷烃的分子式为CnH(2n+2),根据相对分子质量为58,列出方程式进行计算n值;
(5)B、C分别为乙烷和乙烯,将59g乙烯和乙烷的混合气体通入足量的溴水后,溴水增重14为C2H4质量,从而计算出乙烷的质量,再根据n=$\frac{m}{M}$计算乙烯、乙烷的物质的量,最后相同条件下气体体积之比等于物质的量之比计算乙烯占混合气体的体积分数.
解答 解:(1)A为甲烷,其分子式为CH4,甲烷为正四面体结构,甲烷的结构式为: ,
,
故答案为: ;
;
(2)A为甲烷、B为乙烷、C为乙烯、D为丙烷,烯烃的含碳量大于烷烃,则四种物质中含碳量最高的为C,
故答案为LC;
(3)C为乙烯,乙烯分子中含有碳碳双键,能和溴水发生加成反应生成1,2-二溴乙烷,其反应方程式为:CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;加成反应;
(4)A为甲烷,甲烷的同系物中相对分子质量为58,设该烷烃的分子式为CnH(2n+2),则14n+2=58,解得:n=4,
泽尔该烷烃的分子式为:C4H10,
故答案为:C4H10;
(5)B为乙烷、C为乙烯,将59g乙烯和乙烷的混合气体通入足量的溴水后,溴水增重的14g为C2H4的质量,则乙烷的质量为:59g-14g=45g,
混合气体中乙烯的物质的量为:n(C2H4)=$\frac{14g}{28g/mol}$=0.5mol,乙烷的物质的量为:$\frac{45g}{30g/mol}$=1.5mol,
相同条件下气体的体积之比等于其物质的量之比,
则混合气体中乙烯占混合气体的体积分数为:$\frac{0.5mol}{0.5mol+1.5mol}$×100%=25%,
故答案为:25%.
点评 本题考查了有机物结构与性质,题目难度中等,涉及球棍模型的表示方法、有机物分子式确定、混合物的计算等知识,试题知识点较多,充分考查了学生灵活应用基础知识的能力,注意熟练掌握常见有机物结构与性质,明确球棍模型的表示方法为解答关键.

 向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )
向1000mL3mol•L-1NaOH中通入适量CO2气体,溶液中有关阴离子的物质的量变化曲线如图所示:下列说法正确的是( )| A. | 水的电离程度一直增大 | |
| B. | 溶液的pH逐渐下降 | |
| C. | M、N两点对应的溶液中离子种类不同 | |
| D. | CD段反应的离子方程式为OH-+CO2=HCO3- |
| A. | 烧杯 | B. | 蒸发皿 | C. | 蒸馏烧瓶 | D. | 试管 |
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯酚钠溶液中通入少量CO2,可以生成苯酚和碳酸钠 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2─二甲基丙烷与Br2反应,其一溴取代物只有一种 |
| A. | 甲苯的硝化、油脂的皂化均可看作取代反应 | |
| B. | 蛋白质水解生成葡萄糖放出热量,提供生命活动的能量 | |
| C. | 石油裂解的目的是为了提高轻质液体燃料的产量和质量 | |
| D. | 棉花和合成纤维的主要成分是纤维素 |
| A. | MgCl2 | B. | H2O | C. | K2O2 | D. | NaOH |
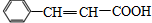
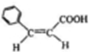 .
. .
.