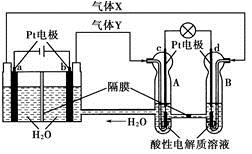
题目内容
图中,用石墨作电极电解饱和氯化钠溶液,Cl2被完全吸收制得有效成分为NaClO的消毒液。下列说法正确的是( )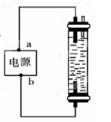
| A.a为正极,b为负极 | B.a为负极,b为正极 |
| C.a为阳极,b为阴极 | D.a为阴极,b为阳极 |
B
解析试题分析:用石墨作电极电解饱和氯化钠溶液的反应方程式为:2NaCl+2H2O Cl2↑+H2↑+2NaOH。若要使反应产生的Cl2被完全吸收制得有效成分为NaClO的消毒液的成分。则Cl2应该在下面的电极产生。根据同种电荷相互排斥,异种电荷相互吸引的原则,Cl2在阳极产生,所以b为正极,a为负极。因此选项为B。
Cl2↑+H2↑+2NaOH。若要使反应产生的Cl2被完全吸收制得有效成分为NaClO的消毒液的成分。则Cl2应该在下面的电极产生。根据同种电荷相互排斥,异种电荷相互吸引的原则,Cl2在阳极产生,所以b为正极,a为负极。因此选项为B。
考点:考查电解饱和氯化钠溶液的应用的知识。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列说法不正确的是:
| A.通过煤的干馏可获得苯、甲苯等芳香烃 |
| B.在海轮外壳装上锌块,可减缓船体的腐蚀速率 |
| C.电渗析法、离子交换法中,只有后者可以应用于海水的淡化 |
| D.我国城市推广使用清洁燃料是压缩天然气类和液化石油气类 |
下列关于铜电极的叙述,不正确的是
| A.铜锌原电池中铜是正极 |
| B.用电解法精炼粗铜时,粗铜作阳极 |
| C.在镀件上电镀铜时可用金属铜作阳极 |
| D.电解稀硫酸制H2、O2时,铜作阳极 |
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+ 4OH-- 4e-= 4H2O;O2+ 2H2O + 4e-= 4OH-。据此作出判断,下列说法中错误的是:
| A.H2在负极发生氧化反应 |
| B.供电时的总反应为:2H2+O2=2H2O |
| C.产物为无污染的水,属于环境友好电池 |
| D.燃料电池的能量转化率可达100% |
下图为两个原电池装置图,由此判断下列说法错误的是( )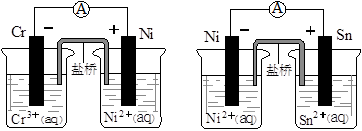
| A.当两电池转移相同电子时,生成和消耗Ni的物质的量相同 |
| B.两装置工作时,盐桥中的阴离子向负极移动,阳离子向正极移动 |
| C.由此可判断能够发生2Cr3++3Ni=3Ni2++2Cr和Ni2++Sn=Sn2++Ni的反应 |
| D.由此可判断Cr、Ni、Sn三种金属的还原性强弱顺序为:Cr>Ni>Sn |
控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
| A.反应开始时,乙中石墨电极上发生氧化反应 |
| B.反应开始时,甲中石墨电极上Fe3+被还原 |
| C.电流计读数为零时,反应达到化学平衡状态 |
| D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极 |
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
电池: Pb(s) + PbO2(s) + 2H2SO4(aq) =2PbSO4(s) + 2H2O(l);
电解池:2Al+3H2OAl2O3+3H2↑电解过程中,以下判断正确的是:
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3molPb | 生成2molAl2O3 |
| C | 正极:PbO2+4H++2e—=Pb2++2H2O | 阳极:2Al+3H2O-6e—=Al2O3+6H+ |
| D |  | 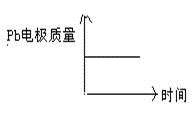 |