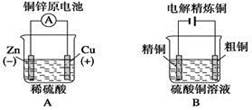
题目内容
氢氧燃料电池已用于航天飞机。以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应如下:2H2+ 4OH-- 4e-= 4H2O;O2+ 2H2O + 4e-= 4OH-。据此作出判断,下列说法中错误的是:
| A.H2在负极发生氧化反应 |
| B.供电时的总反应为:2H2+O2=2H2O |
| C.产物为无污染的水,属于环境友好电池 |
| D.燃料电池的能量转化率可达100% |
D
解析试题分析:由原电池的反应原理可知:通入H2的电极为负极,发生反应:2H2+4OH--4e-=4H2O;通入O2的电极为负极,发生反应O2+2H2O+4e-=4OH-。总反应方程式为2H2+O2=2H2O.由于反应产物是水,所以不会对环境造成污染,属于环境友好电池。由于在反应的过程中有热量变化,所以能量转化率不可能达到100%。因此错误的说法是D。
考点:考查氢氧燃料电池的工作原理的知识。

练习册系列答案
 应用题作业本系列答案
应用题作业本系列答案
相关题目
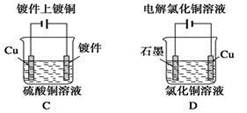
图中,用石墨作电极电解饱和氯化钠溶液,Cl2被完全吸收制得有效成分为NaClO的消毒液。下列说法正确的是( )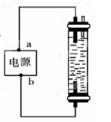
| A.a为正极,b为负极 | B.a为负极,b为正极 |
| C.a为阳极,b为阴极 | D.a为阴极,b为阳极 |
有关下图装置的说法中正确的是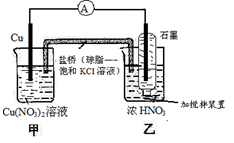
| A.氧化剂与还原剂必须直接接触,才能发生反应 |
| B.乙池中电极反应式为NO3-+4H+ + e-=NO2↑+2H2O |
| C.当铜棒质量减少6.4g时,甲池溶液质量增加6.4g |
| D.当铜棒质量减少6.4g时,向乙池密封管中通入标准状况下1.12LO2,将使气体全部溶于水 |
关于下列各装置图的叙述中,正确的是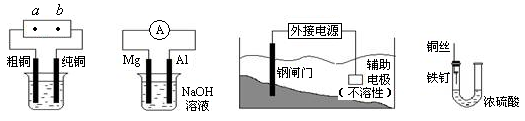
① ② ③ ④
| A.用装置①精炼铜,则a极为电源正极,电解质溶液为CuSO4溶液 |
| B.装置②中Mg为负极 |
| C.装置③中钢闸门应与外接电源的正极相连 |
| D.装置④中的铁钉被腐蚀 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是
| A.水中的钢闸门连接电源的负极 |
| B.金属护拦表面涂漆 |
| C.汽车底盘喷涂高分子膜 |
| D.地下钢管连接镁块 |
如下图所示是某太空空间站能量转化系统的局部示意图,其中燃料电池采用KOH溶液为电解液,下列有关说法中正确的是( )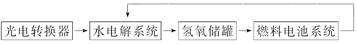
向日面时 背日面时
| A.该能量转化系统工作时,需不断补充H2O |
| B.该转化系统的能量本质上来源于太阳能 |
| C.水电解系统中的阴极反应:O2+2H2O+4e-=4OH- |
| D.燃料电池放电时的负极反应:H2-2e-=2H+ |
肼(N2H4)—空气燃料电池是一种环保型碱性燃料电池,电解质为20%~30%的KOH溶液,电池总反应为N2H4+O2=N2+2H2O。下列关于该电池工作时说法中正确的是
| A.正极的电极反应式:O2+4H++4e-=2H2O |
| B.溶液中的阴离子向正极移动 |
| C.负极的电极反应式:N2H4+4OH--4e-=4H2O+N2 |
| D.溶液的pH保持不变 |
在钢铁腐蚀过程中,下列五种变化可能发生的是( )
①Fe2+转化为Fe3+ ②O2被还原 ③产生H2④Fe(OH)3失水形成Fe2O3·H2O
⑤杂质碳被氧化
| A.只有①和② | B.只有②③④ |
| C.①②③④ | D.①②③④⑤ |